发布日期:2018-11-14 10:13 来源:活性炭网 作者:活性炭网 浏览数:
为了最佳地将玉米壳(玉米加工的副产品)转化为使用 Pachysolen tannophlius的 生物乙醇 ,我们研究了通过活性炭处理水解和去除水解产物中有毒物质的最佳条件以及该解毒过程对动力学参
最近的报告描述了生物乙醇生产的技术和经济影响(Cardona和Sánchez,2007 ; Demirbas,2007 ; Hamelinck等,2005 ; Sánchez和Cardona,2008)。特别是,人们对使用来自农业副产品的木质纤维素材料作为生产生物乙醇的资源非常感兴趣,特别是因为最近作物生产的价格上涨(例如玉米,大米等)。其中,甘蔗bagasses(Aguilar等,2002 ; Gámez等,2006),高粱秸秆(Herrera等,2003 ; Vázquez等,2007),小麦秸秆(Saha等,2005); Yang等,2008),稻草(Karimi等,2006a,b),玉米秸秆(Agbogbo和Wenger,2007 ; Georgieva和Ahring,2007 ; Lau等,2008 ; Ohgren等,2006a,b),玉米芯(Chen等,2007 ; Qu等,2006 ; Vázquez等,2006),和玉米壳(即玉米纤维)(Gáspár等,2007 ; Hespell,1998 ; O') Brien等,2004 ; Schell等,2004)目前正在研究用作生物乙醇生产的资源。为此,已经研究了它们的可发酵糖含量,最佳发酵过程和它们的水解策略。在生物乙醇发酵之前,这些副产物的水解通常使用稀硫酸溶液(Aguilar等,2002 ; Karimi等,2006a),磷酸(Gámez等,2006 ; Vázquez等。 ,2007),或盐酸(Bustos等,2003 ; Herrera等,2003)。此外,利用酶水解(Lau等人,2008 ; Ohgren等人,2006a已经报道了使用酶和稀酸的组合水解方案(Chen等,2007 ; Saha等,2005)。
玉米壳是玉米湿磨过程中产生的残渣。其糖成分各不相同(葡萄糖10~50%,木糖13~49%,阿拉伯糖10~31%,半乳糖3~10%),取决于其来源,水解方法和玉米加工方法(Gáspár等,2007 ; Hespell,1998 ; O'Brien等,2004 ; Schell等,2004)。如今,大多数玉米壳被用作动物饲料,其最近才被用于生物乙醇生产(Dale等,1996 ; Grohmann和Bothast,1997 ; Gulati等,1996 ; Saha等,1998 ; Schell等,2004)。然而,据报道,酸水解产物中的呋喃衍生物(糠醛和5-羟基糠醛)和酚类化合物是有毒的并且可以抑制生物乙醇的产生(Carvalheiro等,2005 ; Chandel等,2007 ; Larsson等, 1999 ; Palmqvist和Hahn-Hägerdal,2000a,b),在酸水解产物中发现约0.6~3.0g / l的水平(Carvalheiro等,2005 ; Chandel等,2007)。在以前的报告中回顾了酸水解产物的解毒作用(Palmqvist和Hahn-Hägerdal,2000a ; Sánchez和Cardona,2008))。活性炭处理导致呋喃衍生物减少92%,5-羟基糠醛减少68%,总酚类化合物减少约1.25-0.5g / l(Carvalheiro等,2005)。
仅有有限的报道观察到玉米壳的酸水解产物的解毒作用对生物乙醇生产的动力学参数的影响。在这项工作中,生理参数的动力学分析作为一种工具进行,以评估这种解毒过程如何影响使用Pachysolen tannophlius生物乙醇生产的动力学参数。此外,我们探索了优化的玉米壳水解方案和通过活性炭处理从水解产物中去除有毒物质。
在该研究中,干燥的玉米壳由Corn Products Korea,Inc。(Icheon,Republic of Korea)友情提供。在水解之前,使用搅拌器将150g干燥的玉米壳研磨5分钟,然后使用筛(筛孔尺寸25)过滤。通过将研磨的玉米壳与100ml硫酸(H 2 SO 4)溶液混合进行水解,然后在121℃下高压灭菌45分钟。通过以4,000rpm离心从上清液中获得水解产物。为了制备用于烧瓶培养实验的水解产物,水解在2 升H 2 SO 4溶液中进行。
用NaOH将水解产物的pH调节至5.5后,将100ml水解产物和10g活性炭(Daejung Chemicals&Metals Co,Republic of Korea)混合,然后通过真空过滤除去活性炭(Carvalheiro)等,2005)。
在该研究中使用酵母Pachysolen tannophilus(P。tannophilus)ATCC 32691。YPX(1%酵母提取物,2%蛋白胨和2%木糖)培养基用于种子培养,YPC(1%酵母提取物和2%蛋白胨在100ml玉米壳水解产物中)培养基用于生物乙醇中的培养瓶培养。生产。将100毫升烧瓶培养物在250 毫升烧瓶中于30℃ 生长并以150rpm摇动。通过使用分光光度计(Spectronic,Thermo Scientific,USA)测量600nm处的光密度(OD 600)来监测细胞生长。使用二硝基水杨酸(DNS)方法(Chaplin和Kennedy,1986)分析培养基中的残余还原糖。
使用Folin-Ciocalteu试剂(Hayashi Pure Chemical Co.,Japan)(McDonald等人,2001)以没食子酸(Sigma)作为标准测量总酚类化合物。在显色反应完成后,将200μl着色溶液转移到96孔微量滴定板中,并使用读板器(Bio-Rad)在655nm处测量其吸光度。
通过薄层色谱(TLC)分析水解产物的单糖含量,使用20×10cm的K5F(Whatman)作为TLC板,乙腈溶液(乙腈:水= 85:15,v / v)用于移动设备相,和1.0的样品加载量微升。对于条带的可视化,将TLC板浸泡在0.5%α-萘酚和5%H 2 SO 4中在乙醇中,然后在80℃的烘箱中干燥15分钟。具体地,通过TLC定量测定水解产物和酵母培养液中还原单糖(葡萄糖,木糖和阿拉伯糖)的量。在同一TLC板上同时开发葡萄糖(0至7%),木糖(0至7%)和阿拉伯糖(0至2%)标准品。使用AlphaEase FC软件(Alpha Innotech,USA)将扫描图像中的单糖条带转化为峰,并且从每种单糖的标准曲线计算它们的量。
还使用火焰离子化检测器(FID)通过气相色谱(HP 6890,Agilent technologies,USA)分析生物乙醇的浓度。使用HP INNOWax柱(Agilent 19091N-113;膜厚度,0.25μm;长度,30μm;内径,0.32mm)。烘箱内的初始温度,最高温度和温度分别为50℃,170℃和10℃/ min。喷射器和FID温度均控制在250℃。使用氮气作为载气,流速为40ml / min。对于定量分析,使用正丁醇作为内标。
生产率和具体生产率计算如下:

其中E 2和E 1分别是在时间t 1和t 2的培养液中的生物乙醇浓度,OD avg是时间t 1和t 2之间的平均细胞生长(OD 600)。
玉米壳在各种浓度的H 2 SO 4(0.5至2.5%,v / v)中水解(图1)。当使用10g玉米壳和100ml H 2SO 4溶液制备水解产物时,水解产物主要由葡萄糖,木糖和阿拉伯糖组成。使用2.0%(v / v)H 2SO 4观察这些单糖中的每一种的最大浓度(图1A和B)。此外,相对于100ml 2.0%(v / v)H 2 SO 4中玉米壳的增加量,水解产物中每种单糖的量增加(图2)。)。然而,当在100 毫升 2.0%(v / v)H 2 SO 4中使用超过25克玉米壳时,大部分H 2 SO 4溶液被吸附到玉米壳中,并且只有极少量的水解产物可以获得。因此,我们决定使用20克玉米壳进行水解,再次检测H 2 SO 4的最佳浓度。如图3所示,当20克玉米壳在100 毫升 3.0至6.0%(v / v)H 2 SO 4中水解时,水解产物中单糖的总浓度范围为66.9至110.6克/ 升。在4.0至6.0%(v / v)H 2 SO 4下,总雌二糖的最大浓度达到104.9~110.6g / l。水解产物中葡萄糖,木糖和阿拉伯糖的平均浓度分别为61.4,35.0和11.6g / l。
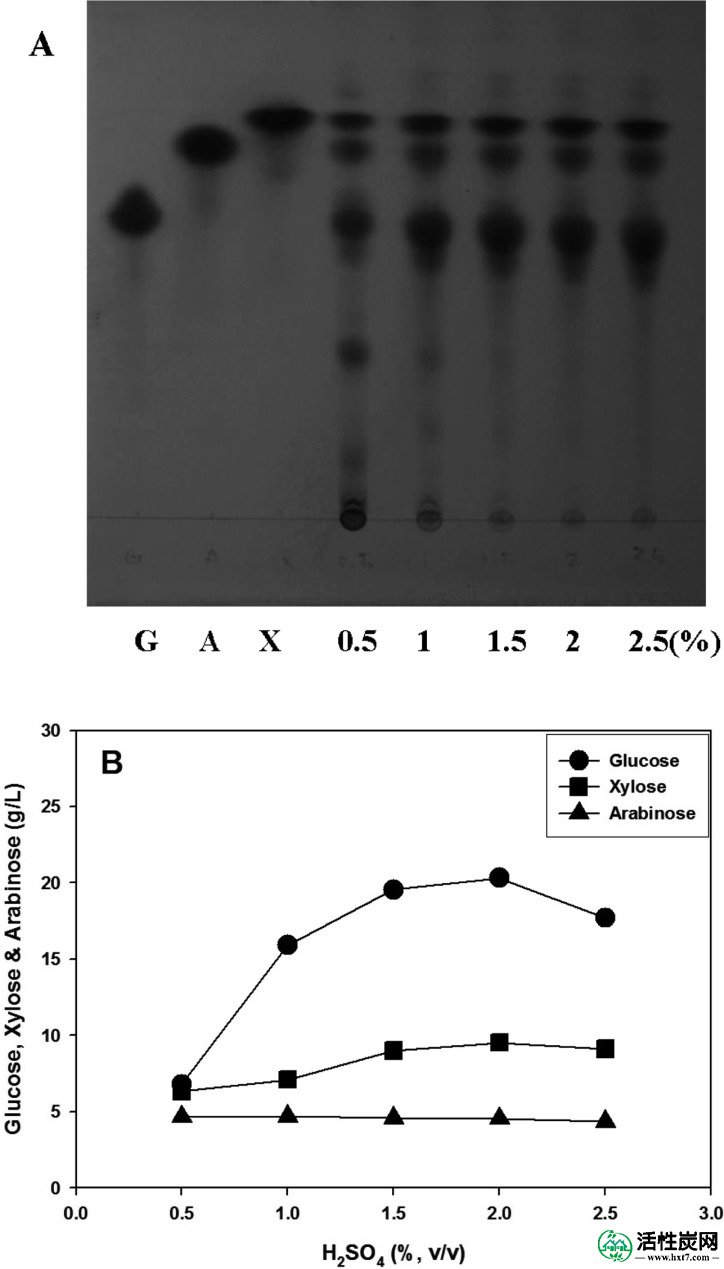
玉米壳的酸水解。A,玉米壳水解产物的TLC。G,A和X分别表示葡萄糖,阿拉伯糖和木糖标准品。H 2 SO 4浓度为0.5,1,1.5,2和2.5%(v / v)。B,水解产物中的葡萄糖,木糖和阿拉伯糖浓度相对于H 2 SO 4浓度的变化。这些数据来自定量TLC。
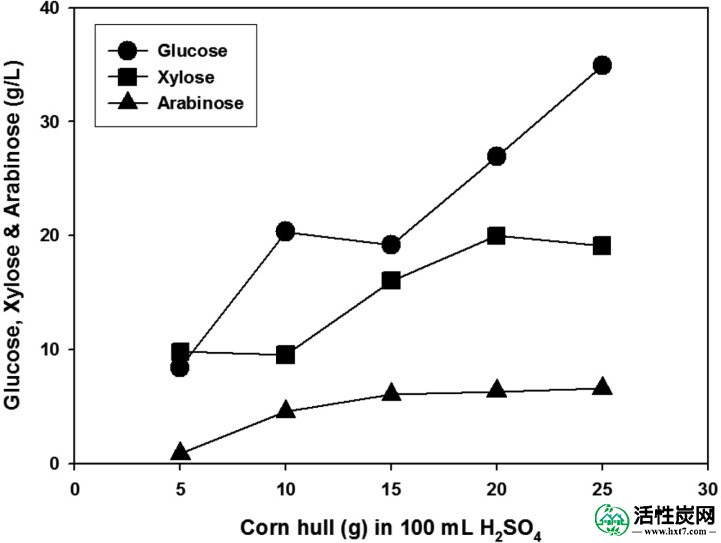
相对于玉米壳浓度的增加,水解产物中的葡萄糖,木糖和阿拉伯糖浓度。2%(v / v)H 2 SO 4用于水解。这些数据来自定量TLC。
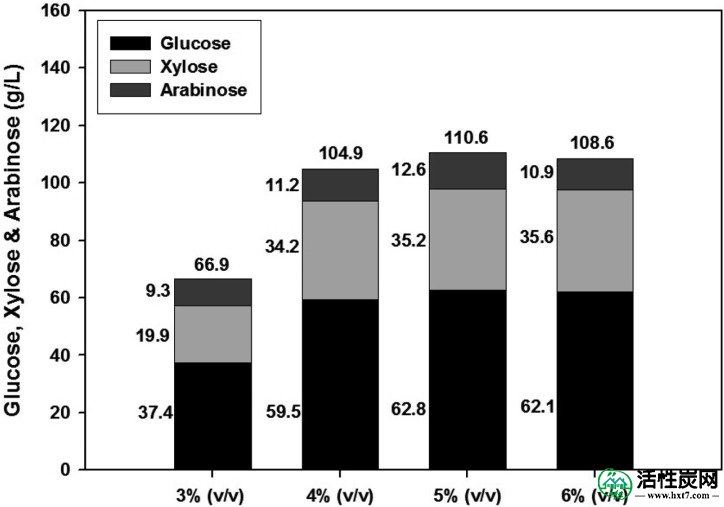
相对于H 2 SO 4浓度的增加,水解产物中的葡萄糖,木糖和阿拉伯糖浓度。将20克玉米壳用于水解。垂直条左侧的值表示水解产物中的葡萄糖,木糖和阿拉伯糖浓度,顶部的值表示三种单糖(即水解产物中的总单糖)的总和。这些数据(n = 5)从定量TLC获得。
在生物乙醇生产过程中,有毒呋喃衍生物(糠醛和5-羟甲基糠醛)和酚类化合物在酸水解过程中产生,并且已知会抑制细胞生长和乙醇生成(Palmqvist和Hahn-Hägerdal,2000b ; Larsson等。 ,1999)。我们使用20g玉米壳和4%(v / v)H 2 SO 4在水解产物制备后通过活性炭处理除去这些化合物。如图4所示,该过程导致总酚类化合物值从2015.2降至153.3mg / l,相当于总酚类化合物减少92.3%。然后将该活性炭处理的水解产物用于生物乙醇生产,并与未处理的水解产物进行比较。
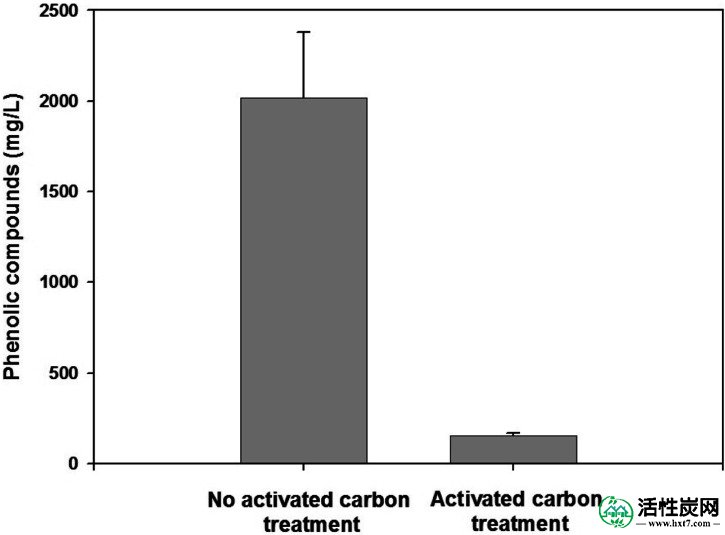
通过活性炭处理除去酚类化合物(n = 3)。
为了探索酸水解玉米壳的活性炭处理如何影响生物乙醇生产,我们进行了两次烧瓶培养:一种使用未处理的水解产物,另一种使用活性炭处理的水解产物作为酵母培养的碳源。如图5所示,两种培养基的嗜嗜热嗜血杆菌的细胞生长曲线相似,尽管当未处理的水解产物时OD 600受中等颜色的影响更严重。然而,葡萄糖,木糖和阿拉伯糖的消费情况明显不同(图6)。当使用活性炭处理的水解产物时,单糖在培养192小时时几乎完全消耗(图6B)),当使用未处理的水解产物时,即使在480小时的培养时,它们也没有被完全消耗(图6A)。例如,当使用未处理的水解产物时,葡萄糖消耗被延迟; 具体地,当使用未处理的水解产物时,葡萄糖在72小时时完全消耗,而当使用活性炭处理的水解产物时,葡萄糖在24小时时完全消耗。
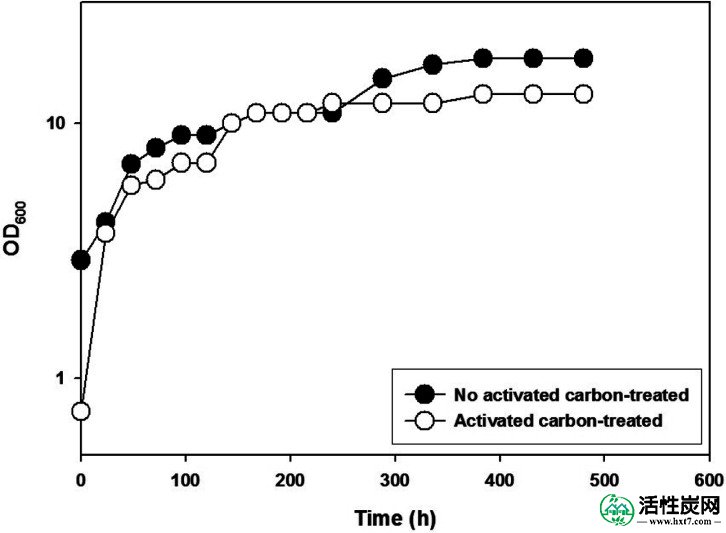
嗜热链球菌在培养瓶中的生长曲线。

TLC分析嗜热链球菌的烧瓶培养液。G,A和X分别表示葡萄糖,阿拉伯糖和木糖标准。
在培养期间,通过DNS(图7A)和定量TLC方法(图7B)两种方法测量总残留还原单糖。尽管DNS和TLC的配置文件可能显示出类似的模式,但它们实际上是不同的。具体地,与TLC相比,通过DNS 测量未处理的水解产物具有10-15g / l的高级单糖。活性炭处理的水解产物通过DNS或TLC显示相同的初始分布; 然而,在192小时后,DNS测量了4~5g / l的单糖,并且TLC显示培养液中检测不到水平。
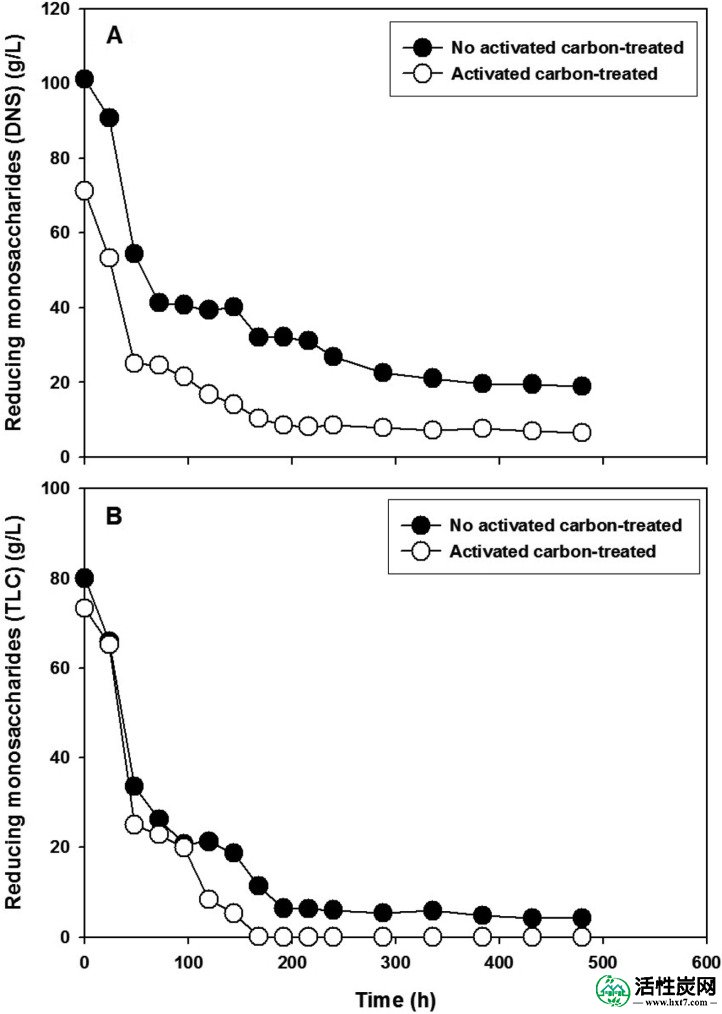
嗜热链球菌烧瓶培养物中还原单糖(葡萄糖,木糖和阿拉伯糖)的消耗曲线。A,DNS方法; B,定量TLC方法。
生物乙醇产量达到22.1克/最大值升,在120小时,此时,使用未经处理的水解产物和达到19.01克/ 升在192小时,此时活性炭处理水解液使用(图8A)。此外,使用活性炭处理的水解产物,生物乙醇产量维持48至192小时,从14.2至19.01g / l,而生产在120小时时用未处理的水解产物中断。同时,当使用未处理的水解产物时,培养物中产生的生物乙醇在120小时开始消耗,而当使用活性炭处理的水解产物时,这发生在192小时。如图8B所示,仅在乙醇浓度增加的范围内计算总生物乙醇产率。当使用未处理的水解产物时,总生物乙醇产率为约0.36,而使用活性炭处理的水解产物,产率为约0.3。图8B中呈现的直线的斜率表示总生物乙醇产率。
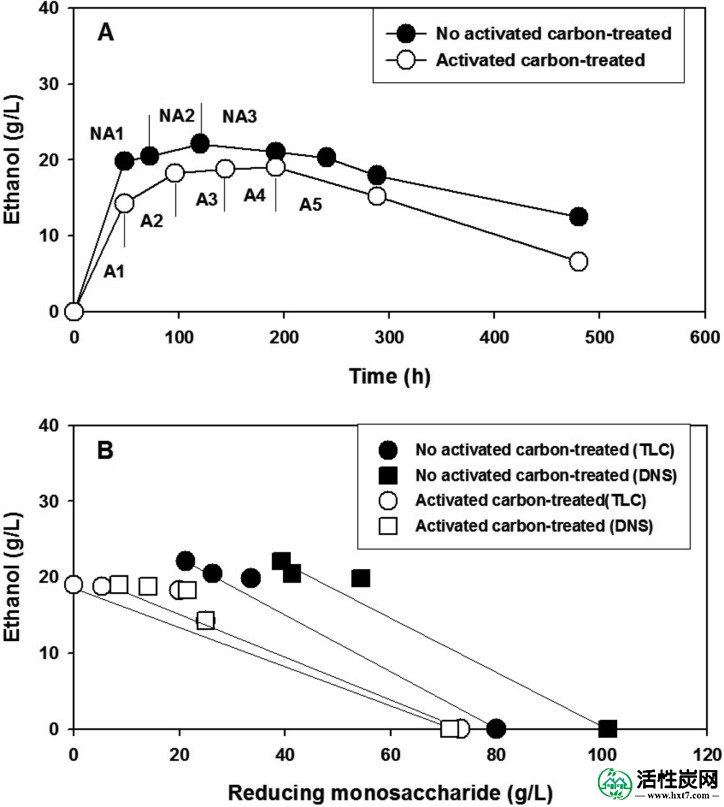
生物乙醇生产概况。A,嗜热嗜热菌培养物中生物乙醇生产的概况。NA1-NA3和A1-A5的含义在文中描述。B,生成的生物乙醇与减少单糖消耗的关系图。该图中使用的数据是从零开始直到生物乙醇浓度达到最大值。直线斜率表示总生物乙醇产量。
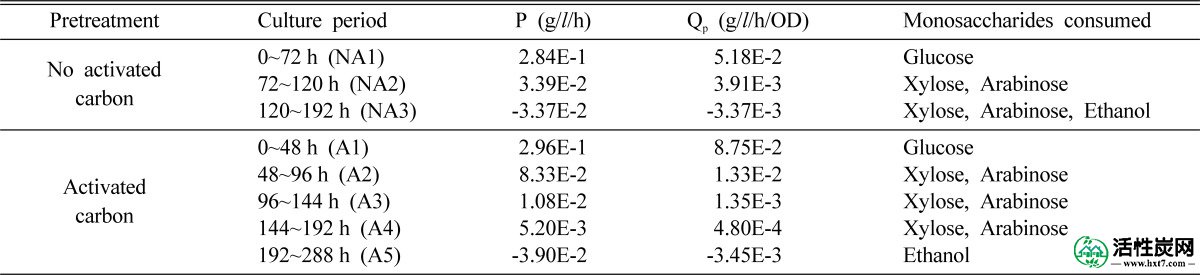
为了评估水解产物的活性炭处理如何影响生物乙醇生产的动力学参数,计算生物乙醇生产率(P)和特定生物乙醇生产率(Q p),如表1所示。当使用活性炭处理的水解产物时,在NA1和A1期间(即葡萄糖消耗期),P略高,并且Q p是使用未处理的水解产物时的1.6倍。此外,当使用活性炭处理的水解产物时,在NA2和A2期间(即,木糖和阿拉伯糖消耗期)P和Q p与未处理的水解产物相比,分别是2.4倍和3.4倍。有趣的是,当使用活性炭处理的水解产物时,木糖和阿拉伯糖在生物乙醇(A2,A3和A4期)的生产过程中继续被消耗,而当使用未处理的水解产物时,木糖和阿拉伯糖仅在NA2期开始消耗。此后,生物乙醇开始与木糖和阿拉伯糖同时消耗(期间NA3)。然而,当使用活性炭处理的水解产物时,通过时间段A5木糖和阿拉伯糖已被完全消耗,然后生物乙醇才开始被消耗。
生物乙醇生产率(P)和特定生物乙醇生产率(Q p)
如图1A中的TLC数据所示,玉米壳完全被H 2 SO 4溶液水解。虽然没有显示所有测试条件的TLC数据,但完全水解的最佳条件包括在100ml 4%(v / v)H 2 SO 4中的 20g玉米壳(图3)。以前的论文报道了用于水解木质纤维素副产物的各种酸浓度,表明2~6%的磷酸(Gámez等,2006 ; Vázquez等,2007),2~6%的盐酸(Herrera等)。 al。,2003),或1~6%硫酸(Aguilar等,2002 ; Karimi等,2006a ; O'Brien等,2004 ; Vázquez等,2006)是最优的。此外,甘蔗渣中酸性水解产物中的总单糖含量为21~26 g / l(Aguilar等,2002 ; Gámez等,2006),高粱秸秆为8~20 g / l(Herrera等,2003) ; Vázquez等,2007),玉米纤维为80~100克/ 升(O'Brien等,2004)。在这项工作中,当水解在4%,5%或6%(v / v)H 2中时,获得超过100 g / l的总单糖SO 4(图3)。这种酸水解是一种流行的过程,并且在许多报道中得到了很好的评价(Mosier等,2005 ; Sánchez和Cardona,2008)。然而,当呋喃衍生物达到约500mg / l的水平时,它们开始严重抑制生物乙醇的产生(Larsson等,1999)。这些负面影响酵母的有氧和无氧代谢和膜通透性(Palmqvist和Hahn-Hägerdal,2000b)。为了从玉米壳水解产物中除去这些有毒化合物,我们试图用活性炭处理水解产物。该方法与其他几种方法一起进行了深入研究(Mosier等,2005)。在这项工作中,虽然我们没有研究通过我们的活性炭处理去除了哪种特定的有毒化合物,但总的酚类化合物被很好地去除,大约减少了92%(图4)。之前的报告表明活性炭处理后酚类化合物减少了60%(Carvalheiro等,2005)。此外,我们观察到我们的活性炭处理导致去除水解产物中存在的深棕色。
在烧瓶培养中,当使用未处理的水解产物时,在零时刻的OD 600显着大于使用活性炭处理的水解产物时的OD 600(图5)。这是H 2 SO 4色差和水解产物中碎片量的结果。此外,当使用未处理的水解产物时,在培养的后期观察到的较高OD 600是由于烧瓶壁上附着的碎片分离到培养基中。从使用DNS(图7A)和TLC方法(图7B)产生的总单糖消耗的概况),我们推断DNS在某种程度上测量了影响测定结果的未知还原物质。换句话说,TLC代表了这些培养物中单糖水平定量的最合理方法。此外,显示在零时刻(图7B)样品中的总单糖比图3中所示的单糖少约20%。这可能是因为在烧瓶培养中所用的水解产物在2的规模制备升,而在水解图1,,2,2,和AND33在100-进行了毫升刻度。在图8B中当使用活性炭处理的水解产物时,与使用未处理的水解产物相比,总生物乙醇产率从0.36降至0.3。然而,其原因是因为当使用活性炭处理的水解产物时总生物乙醇产率的降低表示在葡萄糖被完全消耗后利用木糖和阿拉伯糖。
如图图6,7,7,,图8A,8A,和表1中,使用活性炭处理的水解产物的情况下,葡萄糖消耗速度增加(周期A1)和木糖和阿拉伯糖继续被转换为与未处理的水解产物相比,生物乙醇(时期A2,A3和A4)。此外,通过使用活性炭处理的水解产物提高了生物乙醇生产率和特定生物乙醇生产率。
为了利用嗜铬芽孢杆菌中的木糖,已知木糖通过木酮糖进入戊糖磷酸途径,其中还原能力来自三羧酸循环(Palmqvist和Hahn-Hägerdal,2000a,b)。因此,对于使用嗜热嗜热菌的乙醇生产,通气的精细控制是至关重要的,因为从木糖生产乙醇需要微量加热(Larsson等,1999)。在这项工作中,由于曝气没有得到精细控制,酵母菌株和其他过程完全不同,参数(总产量,P和Q p)可能相对低于其他研究人员的结果(Chandel等, 2007年)。总之,这项工作确定P和Q p得到改善,并且当活性炭处理的水解产物用于由嗜鞣鱼生产生物乙醇时,木糖/阿拉伯糖利用期间生物乙醇生产的可持续性是优越的。