发布日期:2018-11-16 10:57 来源:活性炭网 作者:活性炭网 浏览数:
从葡萄牙中部SoGemil的钻井(钻孔)和温泉水中回收了几种属于同一新型-变形菌属的新物种的分离物。 这些生物在系统发育上最密切相关的是 立克次体 属的严格细胞内未培养物种 ,它
归类于变形菌的γ-亚类的一些生物具有细胞内生命周期,并且其中一些仅在动物,胚胎卵黄囊或动物细胞系中生长。这些严格的细胞内寄生虫包括柯氏柯克斯体(Coxiella burnetii),它感染几种无脊椎动物和脊椎动物,包括人类,其中该生物体是Q热的病原体(42)。这三个种属的Rickettsiella,即,R. grylli,R. chironomi,和R.日本甲虫,也预留节肢动物细胞内寄生虫如昆虫,蜘蛛和甲壳类动物(35,42但是,他们的生理和生化特征知之甚少。
另一方面,军团菌属的种类是原生动物的细胞内寄生虫和也在实验室培养基上生长的动物细胞。该属,例如,一些种类的嗜肺军团菌,引起军团病或疾病称为庞蒂亚克热(的温和的形式15,20)。然而,大多数属的48个有效描述物种的军团菌没有被疾病有关(1,28); 它们是从人造或天然水生环境中分离出来的,采用缓冲的木炭 - 酵母提取物(BCYE)培养基(12)。军团菌种用于木炭的要求,l - 半胱氨酸和铁离子是众所周知的,但这些要求的原因仍然很大程度上尚未确定。木炭可以保护氧自由基它们出现是非常敏感的有机体,对,并且,可能是半胱氨酸的情况下,作为一种必需的营养素(16,17)。多数军团菌在BCYE容易生长,但它已经知道了一段时间,许多,如果不是全部,属种军团,事实上,原生动物的细胞内寄生(1,13,36)。种L. lytica,例如,已经公知的是变形虫的细胞内寄生虫自1956年(10,11)但很久以后就被认为是军团菌属的一种(18)。最近,从几种水源获得的变形虫中分离出新种L. drozanskii,L。rowbothamii和L. fallonii,强化了这些生物主要是原生动物的细胞内寄生虫的假设(1),或者作为动物病原体,是细胞内的巨噬细胞寄生虫。
天然地热区已知由属的物种中广泛定植军团菌(25,40)。在所研究的温泉和径流中,葡萄牙中部SãoGemil的浅河床上有自然通风口。在葡萄牙法律要求的钻井(钻孔)和SãoGemil温泉水中的军团菌的常规后续质量控制计数中,我们最近分离了含有甘氨酸,万古霉素,多粘菌素B和环己酰亚胺的BCYE上的几种生物。 (GVPC)具有菌落形态,与粉红色或蓝色菌落无法区分,具有军团菌的磨砂玻璃质地种类。脂肪酸分析表明,这些菌株属于我们军团菌脂肪酸数据库中未包括的两个不同物种,可能属于该属的新物种(8)或其他属的物种。16S rRNA基因序列分析表明,这些生物体代表了一个新种属的两个物种,其最接近的分类学定义的亲属是立克次氏体属的不可培养物种。
在16S rRNA基因序列分析和生理学,生物化学和分子遗传学分析的基础上,我们认为菌株SGT-39 T代表一种新物种,我们建议将其命名为Aquicella lusitana(CIP 107650,LMG) 21647),而应变SGT-108 Ť表示相同的新的属,为此我们建议名称的第二物种Aquicella siphonis(CIP 107651,LMG 21648)。
菌株SGT-39 T,SGT-53,SGT-56,SGT-107,SGT-108 T,SGT-109和SGT-110均来自位于葡萄牙中部SãoGemil的钻孔和治疗水疗中心的水样。将水样在环境温度下输送到实验室,并在取样12小时内通过45mm直径的膜过滤器(Gelman; Supor 200;0.2μm孔径)过滤。将过滤器置于含有10ml原水的小型无菌塑料袋中。将含有过滤器的袋子手动摩擦几分钟以从过滤器中除去有机物; 将一部分样品(0.1ml)直接置于含有GVPC(6)的BCYE培养基(12)的表面上并且遍布整个表面。将另一部分样品在室温下酸处理(3.9ml 0.2M HCl-25ml 0.2M KCl,pH 2.2)5分钟,然后在BCYE-GVPC板(2)上涂布(0.1ml ),同时将第三部分样品在50℃下热处理30分钟,然后涂布在相同介质的板上(7)。将板在37℃下孵育长达9天。通过在BCYE上传代培养来纯化培养物,并将其在含有15%(体积/体积)甘油的5%(wt / vol)酵母提取物中保持在-70℃。军团菌属的类型和参考菌株。嗜肺军团菌(ATCC 43109),L。anisa(ATCC 35292 T),L。oakridgensis(ATCC 33761 T)),L. bozemanae(ATCC 33217 Ť),L. longbeachae(ATCC 33462 Ť),和L. micdadei(ATCC 33218 Ť)获自美国典型培养物保藏中心,Manassas,弗吉尼亚州获得的,并且一个嗜肺军团菌菌株中分离来自SãoGemil,指定为SGM-50,也用于比较目的。
测试了几种培养基以试图培养SGT菌株并促进其表征。常见的微生物培养基,即营养琼脂,胰蛋白酶大豆琼脂,Mueller-Hinton琼脂和脑心浸液琼脂(Difco),用30mM ACES(N - [2-乙酰氨基] -2-氨基乙磺酸)缓冲至pH 6.7并且在没有活性炭或添加2.0g活性炭升-1的情况下使用。还检查了具有5%羊血(Becton Dickinson,Sparks,Md。)和巧克力琼脂(Becton Dickinson)的Columbia III琼脂的生长。还尝试了两种低营养培养基的生长,这些培养基通常用于从热源中分离和培养生物,培养基630(Deutsche Sammlung von Mikroorganismen und Zellkulturen; www.dsmz.de/media/med630.htm)和黄栖热介质(www.dsmz.de/media/med878.htm),其是除了酵母提取物和胰蛋白胨(的浓度非常相似的5,44)。用ACES将两种培养基调节至pH6.7,并检查有和没有木炭(2.0g升-1)的生长。
还研究了这些生物在基本BCYE培养基的几种修饰形式上的生长; 修饰包括单独或组合省略木炭,1-半胱氨酸,α-酮戊二酸和焦磷酸铁。还检查了在与BCYE相同的培养基中的生长,其中酵母提取物被3.0g胰蛋白胨或Casamino Acids升-1代替。
还设计了液体培养基以获得这些生物的生长参数。该液体培养基,命名为BYE-L,基于BCYE的组成如下。将含有木炭(2.0g升-1)的琼脂(12.5ml,1.5%; Difco)在50ml宽口螺旋盖管中高压灭菌。使炭琼脂凝固,并将薄层(2.5ml)高压灭菌的1.5%琼脂琼脂覆盖在炭琼脂层上。该层也被固化。在该层之上12.5毫升酵母提取物-的升倒入半胱氨酸液体培养基(不含木炭的BCYE),留下约20ml的顶部空间。将培养瓶储存过夜以使BYE-L在所有层中平衡。营养物的最终浓度与固化的BCYE培养基中的浓度大致相同。液体介质之间的琼脂层阻止了木炭颗粒在液体介质中的再悬浮。管底部的木炭琼脂层是生长所必需的,因为所检查的SGT菌株或军团菌属没有木炭生长。将培养物在37℃下不振荡温育。
在BCYE上培养后,在相差显微镜下检查细胞形态和运动性。检测BCYE和BYE-L培养基在22至50℃的温度范围内的生长5天。将板用塑料袋包裹并浸没在水浴中,将温度控制在0.1℃以内。将液体培养物置于水浴中,通过测量浊度(610nm处的光密度)检查生长。生长的pH范围在37°C BCYE和BYE-L中用30 mM MES(2- [ N-吗啉代]乙磺酸)缓冲,pH值在5.5和6.5之间,ACES中pH值在6.0和7.5之间。在HEPES中pH值在6.5和8.2之间,在TAPS中(N.-tris [羟甲基]甲基-3-氨基丙磺酸),pH值在7.5和9.0之间。将含有调节至pH 6.7的每种缓冲液的对照培养基用于评估缓冲剂的可能的抑制作用。
如Smibert和Krieg(38)所述测定过氧化氢酶,细胞色素氧化酶和硝酸盐的还原。如前所述检查马尿酸盐和酪蛋白的水解(41)。根据制造商的说明书,使用API ZYM测试系统(BioMérieux,Marcy l'Etoile,France)在37℃下测定其他酶活性。在含有H 2 -CO 2气氛(GENbox anaer;BioMérieux)的厌氧室中,在37℃下对BCYE,血琼脂和巧克力琼脂进行厌氧生长。用CO 2检查相同介质中的微需氧生长发电机(GENbox microaer;BioMérieux)。在BCYE上生长3天和5天后检查长波紫外光(365nm)下的自发荧光。
评估含有5.0g过滤灭菌葡萄糖升-1的 BYE-L培养基中葡萄糖的同化作用。使葡萄糖在所有管的层中在室温下平衡24小时。接种管以产生约0.05的初始浊度(610nm处的光密度)。接种后立即取两份培养物,并在-20℃冷冻,以便随后分析初始葡萄糖浓度。孵育5天后,也从相同的管中除去重复的部分。离心这些样品,用葡萄糖氧化酶 - 过氧化物酶测试试剂盒(510-DA; Sigma-Aldrich)估算上清液中的葡萄糖消耗。
还检测了在没有α-酮戊二酸的BCYE培养基中葡萄糖,果糖,丙酮酸盐,琥珀酸盐,苹果酸盐,柠檬酸盐,草酰乙酸盐,天冬酰胺,谷氨酰胺和酪蛋白氨基酸(均过滤灭菌并且终浓度为1.0g升-1)的生长。
维持在37℃(作为对照),48,55和60℃的水中生物的存活估计如下。将来自SãoGemil的钻孔(钻井)的水过滤(Gelman; Supor 200; 0.2-μm孔径),并将15ml分配在金属加盖的管中。将3天龄的培养物重悬于该无菌水中至浊度相当于McFarland no。1标准(38)。将管在温度控制的水浴中温育最多48小时。在接种后和1,3,6,10,24和48小时后立即取样。通过在BCYE上直接从悬浮液中扩散0.1ml部分和在无菌钻孔水中连续稀释来测定存活率。将培养物在37℃温育3天后测定CFU。
如前所述(14)生长H. vermiformis。与菌株SGT-39这个变形虫的共培养物中Ť和SGT-108 Ť在25毫升的组织培养烧瓶中制备(10毫升)中。将变形虫的数量调节至1.4×10 5 ml -1,并将共培养物在35℃温育。对照烧瓶由相同培养基中的细菌组成。如先前在补充有10%胎牛血清,无抗生素(RPMI 1640培养基描述中生长的U937细胞14,29)。如上所述制备共培养物,将U937细胞调节至4×10 6升-1。在制备共培养物后立即以7天内的适当时间间隔获得样品。在37℃温育最多7天后,在BCYE上计数CFU。
菌株SGT-39 T,SGT-56,SGT-108 T和SGT-109对含有氨苄青霉素(10μg),羧苄青霉素(100μg),头孢噻吩(30μg),头孢唑啉(30μg)的圆片(BioMérieux)的抗生素敏感性),氯霉素(30μg),环丙沙星(5μg),强力霉素(30μg),红霉素(15μg),庆大霉素(10μg),卡那霉素(30μg),林可霉素(2μg),萘啶酸(30μg) ,新霉素(30μg),氧氟沙星(5μg),青霉素G(10 U / IE),多粘菌素B(300 U / IE),利福平(30μg),链霉素(10μg),四环素(30μg),和检查在37℃下BCYE上的万古霉素(30μg)72小时。
用于极性脂质分析的培养物在BCYE中生长72小时。如先前所述(进行培养和脂质的提取收获9,32)。通过硅胶G板(Merck; 0.25mm厚)上的单维薄层色谱(TLC)分离各个极性脂质,溶剂系统由氯仿 - 甲醇 - 乙酸 - 水(80:12:15:4)组成。体积)。从冷冻干燥的细胞中提取脂醌,通过TLC纯化,并使用Gilson高效液相色谱仪通过使用反相柱(RP18; Spherisorb; S5 ODS2)和甲醇 - 庚烷(10:2,vol / vol)作为流动相,在269nm处检测到(39)。
用于脂肪酸分析的培养物在BCYE琼脂平板上生长,所述平板在37℃下在密封的塑料袋中孵育72小时。如Kuykendall等人先前所述,通过皂化,甲基化和提取从新鲜湿生物质获得脂肪酸甲酯。(22)并用MIS文库生成软件(Microbial ID Inc.,Newark,Del。)分离,鉴定和定量。
如Wiedmann-al-Ahmad等所述,将粗细胞裂解物用作随机扩增多态性DNA(RAPD)分析的DNA模板。(43)。进行扩增反应,总体积为50μl,含有1.5U Taq聚合酶,1.5mM MgCl 2(Pharmacia Biotech),0.2mM(各)脱氧核苷三磷酸,0.6μM引物OPA3(5'-AGTCAGCCAC-3'),和2.0μl粗细胞裂解物。如下进行45个循环的扩增(Perkin-Elmer;模型240):在94℃下1分钟,在34℃下1分钟,在72℃下2分钟,然后是7分钟的最终延伸步骤。在94°C。通过在Tris-乙酸盐-EDTA缓冲液中的2%琼脂糖凝胶中电泳分析片段。
从嗜肺军团菌和猕猴桃的SGT菌株中分离染色体DNA 以评估mip,dotA和traA样基因的存在如Rainey等人所述。(33)。如前所述,使用引物MIPF和MIPR扩增部分mip基因(34)。用于扩增dotA基因片段的引物是Ko等人使用的引物。(21)。基于traA样嗜肺军团菌序列的引物被用于检测新基因中是否存在该基因(31))。还设计了一对简并引物TF(5'-CTBGTHGGHGAYCCGSAWCAG-3')和TR(5'-GTCRBSGCATARCCGTRRTCSA-3'),基于来自L的traA样基因(GenBank登录号AF315650)的序列比对。嗜肺军团菌(31)和来自Mesorhizobium loti(BAB48437),根瘤菌(Rhizobium sp。)和根癌农杆菌(Agrobacterium tumefaciens)的基因同源物(23)。PCR扩增在Perkin-Elmer GeneAmp PCR System 2400中进行,在50μl含有100ng来自每个菌株的DNA,200ng每种引物,10mM Tris-HCl(pH9.0),2.5mM MgCl 2的反应混合物中进行。,50mM KCl,1U TaqDNA聚合酶(Promega)和0.2mM(各)脱氧核苷三磷酸。在琼脂糖凝胶电泳后观察dotA片段(0.4kb),mip片段(0.6至0.7kb)和traA样片段(0.6kb)。PCR条件如下:在94℃初始变性5分钟,然后在94℃变性30分钟,在50℃退火1分钟,在72℃延伸引物1分钟的30个循环。最后一个循环中的延伸反应延长7分钟。
如Cashion等人所述,分离用于测定DNA的鸟嘌呤 - 胞嘧啶(G + C)含量的DNA。(3)。如Mesbah等人所述,通过高效液相色谱法测定DNA的G + C含量。(26)。如前所述(33)进行基因组DNA的提取以进行16S rRNA基因序列测定,16S rRNA基因的PCR扩增和纯化的PCR产物的测序。用310型遗传分析仪(Applied Biosystems,Foster City,CA)对纯化的反应混合物进行电泳。在这项研究中所确定的16S rRNA基因序列,针对成员的代表性的参考序列进行比对变形菌门与AE2编辑器(24)。Jukes和Cantor(19)的方法用于计算进化距离。使用PHYLIP包中包含的各种树算法生成系统发育树状图(J.Felsenstein,PHYLIP [系统发育推理包],版本3.5.1,遗传学系,华盛顿大学,西雅图,1993)。
对于菌株SGT-39的16S rRNA基因序列Ť,SGT-108 Ť,和SGT-109下保藏号保藏EMBL AY359282,AY359283,和AY359284,分别。
具有与军团菌种类相同的菌落形态的生物2000年3月至7月期间,从钻井(钻孔)和SãoGemil的BCYE-GVPC培养基中的水疗中心分离出四次。钻孔,称为HDN1,已经钻成花岗岩层,深度为91.0米,额外的进水口在61到67米之间,在76到82米之间。通风口温度为48°C,pH值为8.4; 水疗中心的两个地点的水温为37至40°C,pH值为8.0。从酸处理和热处理的样品和未处理的样品中回收分离物。这些生物是革兰氏阴性的非运动杆状细胞,在BCYE上有细丝。在解剖显微镜下,菌落发白,带有粉红色或带蓝色的光泽和磨砂玻璃质地。在37℃下在BCYE上孵育3或5天后,我们未观察到SGT菌株中的蓝白色或红色自发荧光。这些生物产生的菌落与其物种的菌落难以区分军团菌和最初被认为是该属的分离物。菌株SGT-39 Ť,SGT-56,SGT-108 Ť,和SGT-109长在BCYE和所需α酮戊二酸和木炭的生长,但也增加了在BCYE培养基缺乏升 -半胱氨酸和焦磷酸铁。有机体在Degryse培养基162上生长,缓冲至pH 6.7并补充了木炭和α-酮戊二酸,但在Thermus中没有介质。没有任何菌株在使用或不使用木炭的任何其他培养基上生长。为了使SãoGemil菌株生长,需要向BCYE或Degryse培养基162中加入α-酮戊二酸或丙酮酸盐。这些生物不会在BCYE上生长,其中这些有机酸被葡萄糖,果糖,天冬酰胺,谷氨酰胺,琥珀酸盐,苹果酸盐,柠檬酸盐,草酰乙酸盐或酪蛋白氨基酸取代。的对照培养嗜肺军团菌,L. bozemanae,和L. oakridgensis其中,α酮戊二酸用丙酮酸盐,琥珀酸盐,草酰乙酸和(表替换上BCYE生长(表1)。1)。菌株SGT-108 T和SGT-109,与菌株SGT-39 T不同和SGT-56,生长在缓冲炭- 升,其中酵母提取物通过胰蛋白胨替换半胱氨酸-α酮戊二酸介质(3.0克升-1)。
区分SGT菌株与军团菌属的表型特征。
| 特性 |
结果a:
|
||||||
|---|---|---|---|---|---|---|---|
| SGT-39T. | SGT-56 | SGT-108T. | SGT-109 | L. bozemanae | L. oakridgensis | 嗜肺军团菌 | |
| 成长: | |||||||
| BCYE-INC b | + | + | + | + | - | + | - |
| BCYE与丙酮酸c | + | + | w ^ | w ^ | + | + | + |
| BCYE与琥珀酸酯c | - | - | - | - | + | + | + |
| BCYE与草酰乙酸酯c | - | - | - | - | + | + | + |
| BCYE用胰蛋白胨d | - | - | + | + | ND | ND | ND |
| BYE-L e的增长(平均最终浊度) | 0.430 | 0.412 | 0.320 | 0.345 | 0.585 | 0.605 | 0.820 |
| 水解: | |||||||
| 酪蛋白 | - | - | w ^ | w ^ | + | + | + |
| 马尿 | + | + | + | + | - | - | + |
| 存在: | |||||||
| α-糜蛋白酶 | + | + | - | - | - | - | - |
| 过氧化氢酶 | - | - | - | - | + | + | - |
| 胱氨酸芳基酰胺酶 | - | - | - | - | + | + | + |
菌株SGT-39 T和SGT-56在30至43°C之间持续增长,而菌株SGT-108 T和SGT-109在30至40°C之间生长,但在7或之后没有菌株生长在25或45°C孵育BCYE平板的天数。菌株生长的pH范围令人惊讶地狭窄; 菌株SGT-39 Ť和SGT-56上生长的pH 6.3和7.3之间BCYE板,而菌株SGT-108 Ť和SGT-109的pH 6.3和7.0之间生长在BCYE板。在pH 6.0或7.5下未观察到生长。在该研究中检查的一些军团菌属的菌株也具有非常窄的生长pH范围。例如,L.anisa(6.5至7.3)和L. oakridgensis的生长的pH范围(6.5至7.7)也出乎意料地变窄(结果未显示)。
我们还设计了一种液体培养基,命名为BYE-L,基于BCYE的营养成分,在生长温度范围和pH范围内获得更精确的结果。该培养基青睐的几个物种的生长军团菌和SGT生物体(表(表1),1),和与所述BYE-L培养基中获得的结果证实了这些与BCYE琼脂上。
这两种生物是过氧化氢酶和细胞色素氧化酶阴性。酪蛋白是由应变SGT-108降解Ť但不受应变SGT-39降解Ť,和其它蛋白质底物的水解不能在BCYE培养基上观察到由于木炭。两种菌株均使Hippurate水解。菌株SGT-39 Ť和SGT-108 Ť曾在API ZYM试验相同的酶活性(表(表1)。1)。有机体在厌氧条件下不生长,但在微生物上生长。硝酸盐没有减少。在有氧条件下,BYE-L不同化葡萄糖,当培养物在微需氧或厌氧条件下培养时,也不产生酸,表明该糖未发酵。除万古霉素,多粘菌素B和林可霉素外,生物对所有测试的抗生素都敏感。
菌株SGT-39的恢复Ť和SGT-108 Ť在钻孔水温育在37℃下经48小时下降了29%。在48和55℃的温育温度下,生物体分别在10和6小时后没有回收,也不能在60℃下1小时后回收生物(结果未显示)。
应变SGT-39的细胞内生长Ť在H. vermiformis,估计为在37℃的增加CFU后7天温育后,大约四倍; 在H. vermiformis共培养7天后,CFU数从5.4×10 2 ±78 ml -1增加到2.27×10 3 ±183 ml -1。菌株SGT-108 T在该变形虫中的生长相似,CFU从2.4×10 2 ±57 ml -1增加到9.3×10 2 ±150 ml -1。3天后,没有变形虫从没有变形虫的培养基中回收。在孵育7天后,两种菌株在与人淋巴瘤U937细胞系的共培养中变得不可检测。
二磷脂酰甘油,磷脂酰乙醇胺,磷脂酰甘油和磷脂酰胆碱占SãoGemil菌株的极性脂质组成。泛醌11(Q11)是SGT-39的主要呼吸醌Ť和SGT-108 Ť菌株,随后少量Q9,Q10,以及Q12(结果未示出)。SGT生物的主要脂肪酸为17:0 iso,尽管SGT-39 T,SGT-56和SGT-110(14%至21%)所代表的物种的浓度低于菌株所代表的物种。 SGT-108 T和SGT-109(38%和40%)。在这些生物体中以残留量检测到反异脂肪酸。单不饱和脂肪酸,即,17:1ω9 Ç异,11甲基18:1ω7Ç,和19:1ω9 Ç,也将圣保罗Gemil生物体的占主导地位的酰基组件。羟基脂肪酸,如异13:0 3OH,异丙15:0 3OH,和异19:0 3OH,分别为这些生物体的中等脂肪酸组分并分别在彼此(表区分两个物种有用的(表2) 。2)。0 3OH菌株SGT-39:两个物种可以通过异19的存在是从容易地彼此区分Ť,SGT-56,和SGT-110和11甲基18的存在:1ω7 Ç菌株SGT-108 T和SGT-109。一种具有17.495的等效链长(ECL)的未知脂肪酸也是SGT生物的酰基链的主要成分,但未被鉴定。
意味着菌株SGT-39的脂肪酸组合物Ť,SGT-56,SGT-110,SGT-108 Ť,和SGT-109在BCYE琼脂生长后
| 脂肪酸a |
脂肪酸组成(%):
|
||||
|---|---|---|---|---|---|
| SGT-39 T. | SGT-56 | SGT-110 | SGT-108 T. | SGT-109 | |
| 12:0 3OH | 0.5 | 1.0 | 0.4 | - f | - |
| i13:0 3OH | 5.6 | 5.9 | 3.4 | 2.0 | 1.7 |
| 13:0 2OH | 0.4 | 0.4 | 0.2 | - | - |
| I15:0 | 2.6 | 2.7 | 2.3 | 2.0 | 2.1 |
| 15:0 | - | - | - | 0.2 | 0.4 |
| I16:0 | 0.4 | 0.3 | 0.4 | 0.3 | 0.7 |
| 特写4 b | 1.4 | 2.9 | 1.6 | 0.3 | 0.2 |
| 16:0 | 2.0 | 3.1 | 2.3 | 3.2 | 3.1 |
| i15:0 3OH | 0.4 | 0.5 | 0.3 | 4.6 | 4.7 |
| i17:1ω9c | 9.5 | 11.1 | 8.8 | 14.3 | 15.0 |
| 特征5 c | 0.8 | 0.5 | 0.4 | 0.6 | 0.4 |
| I17:0 | 21.0 | 14.2 | 15.3 | 38.2 | 39.7 |
| A17:0 | 1.1 | 0.9 | 1.2 | 1.4 | 1.2 |
| Cyclo17:0 | 7 | 11.1 | 9.3 | 1.1 | 0.8 |
| 17:0 | 1.8 | 1.9 | 2.0 | 5.2 | 4.9 |
| 未知的d | 11.1 | 6.9 | 11.8 | 12.4 | 12.0 |
| I18:0 | 0.6 | 0.7 | 0.7 | 0.4 | 0.9 |
| 特征7 e | 1.8 | 3.4 | 1.8 | 0.6 | 0.2 |
| i17:0 2OH | 0.4 | 0.3 | 0.5 | - | 0.2 |
| i18:1ω5c | 0.5 | 0.3 | 0.5 | 0.2 | 0.1 |
| 18:0 | 4.5 | 6.2 | 7.8 | 4.2 | 4.2 |
| 11甲基18:1ω7c | - | - | - | 2.6 | 2.6 |
| i19:1ω9c | 4.5 | 3.2 | 3.3 | 1.1 | 0.7 |
| I19:0 | 6.7 | 5.3 | 8.8 | 2.6 | 1.5 |
| A19:0 | 0.8 | 0.9 | 1.0 | 0.2 | 0.2 |
| Cyclo 19:0ω8c | 5.2 | 4.7 | 6.1 | 1.7 | 1.5 |
| 19:0 | 0.9 | 0.7 | 1.3 | - | 0.4 |
| 20:0 | 0.4 | 0.4 | 0.5 | - | 0.1 |
| i19:0 3OH | 6.1 | 6.6 | 5.8 | - | - |
RAPD分析结果表明菌株SGT-39 Ť,SGT-53,SGT-56,SGT-107,和SGT-110属于同一克隆尽管被隔绝在从温泉和钻孔四个不同的场合。在另一方面,菌株SGT-108 Ť和SGT-109表示从钻孔(图隔绝在一个场合的两个克隆(图1)。1)。的MIP,DOTA和TRAA样基因没有在通过PCR扩增的SGT的菌株中遇到。我们的结果证实了在嗜肺军团菌(ATCC 43109),嗜肺军团菌 SGM-50和L. anisa中存在mip基因序列(图。(图2)。2)。的 DOTA在检测基因嗜肺军团菌检测的菌株(图(图2)。2)。该 TRAA中检测样基因嗜肺军团菌,但不是在新生物(结果未显示)。
RAPD的琼脂糖凝胶电泳。泳道1,标记IV(Roche Molecular Biochemicals); 泳道2〜8,与从DNA引物OPA3产生的产物SGT-39 Ť(泳道2),SGT-53(泳道3),SGT-56(泳道4),SGT-107(泳道5),SGT-110(泳道6),SGT-108 Ť(泳道7),和SGT-109(泳道8)。

PCR扩增的部分mip和dotA基因的琼脂糖凝胶电泳。泳道1,标记IV(Roche Molecular Biochemicals); 泳道2至6,用引物LegmipF和LegmipR(34)从嗜肺军团菌(ATCC 43109 )的DNA (泳道2),嗜肺军团菌 SGM-50(泳道3),L。anisa ATCC 35292 T(泳道4 )产生的产物),SGT-39 T(第5道)和SGT-108 T(第6道); 泳道7至11,用引物DL1和DL2(21)从嗜肺军团菌 DNA (泳道7),嗜肺军团菌 SGM-50(泳道8),L。anisa ATCC 35292扩增的产物Ť(泳道9),SGT-39 Ť(泳道10)和SGT-108 Ť(泳道11)。
包括1490名1482个核苷酸几乎完全的16S rRNA基因序列为菌株SGT-39测定Ť和SGT-108 Ť分别。与下降的域内的主要线的代表这些序列的比较细菌表明这些菌株是对的γ亚类的成员变形菌并最密切相关的含有谱系军团菌和Rickettsiella物种(图(图3).3)。菌株SGT-39之间的成对的16S rRNA基因序列相似Ť和SGT-108 Ť是94.0%。与新分离株序列具有最高配对相似性(92%)的16S rRNA基因序列是从农业土壤中回收的未发表的环境16S rRNA基因序列(GenBank登录号AJ252618),其中转基因和非转基因马铃薯植物已经长大的。与先前描述的军团菌和立克次氏体属的分类群的相似性<90%。应变SGT-39的DNA Ť和SGT-108 Ť有G + C为44.9和48.3摩尔%的含量,分别。
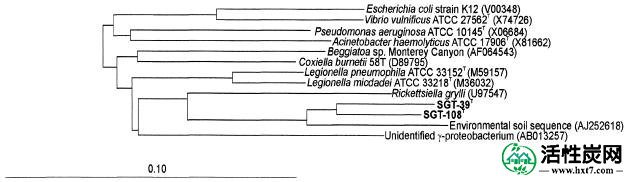
基于16S核糖体DNA基因序列比较的系统发育树状图显示了SGT菌株在变形菌的γ-亚类的代表性分类群的辐射中的位置。比例尺,每100个核苷酸10个推断的核苷酸取代。
由菌株SGT-39所表示的两个新的物种Ť和SGT-108 Ť包括一种新颖的分支中的γ-变形菌内,其近亲是属的物种Rickettsiella和军团菌。Rickettsiella属的种类从未在人工培养基中生长,它们的特征在很大程度上是未知的,因此不能将这些细菌与SãoGemil生物进行比较。对于由环境16S rRNA基因序列(GenBank登录号AJ252618)表示的生物体也是如此), which has not been cultured but, based on its relationship to the SGT organisms, could represent an additional, as yet uncultured, species of the genus proposed here. The new organisms can, however, be compared to the species of the genus Legionella to which they are also phylogenetically related. The new organisms, like the species of the genus Legionella, require activated charcoal for growth but, unlike the vast majority of species of Legionella, do not require l-cysteine or ferric pyrophosphate (17, 27). The São Gemil organisms have an absolute requirement for α-ketoglutarate or pyruvate which, in the Legionella strains examined, could be replaced by succinate and oxaloacetate. These organic acids do not serve as carbon and energy sources but appear to be involved in oxidative stress protection (30). The SGT organisms, like most isolates of the genus Legionella, also tolerate the acid and the heat treatments designed to reduce contaminant flora. Since they were isolated from BCYE-GVPC medium, it was not surprising that they were resistant to vancomycin and polymyxin B, used as selective agents during isolation.
然而,脂肪酸组成的差异表明新生物不是军团菌属的成员。这些新生物的链长比军团菌中的链长更长。此外,主要的脂肪酸之一仍然是未知的,但还没有在任何属的物种被发现军团菌(1,8)。
由于难以在评估用于描述其他细菌种类的许多表型参数所需的条件下培养生物体,因此仅确定了一些生理和生物化学特征。然而,这两种生物基于生长温度范围,pH范围和脂肪酸组成清楚地代表不同的物种。菌株SGT-39 Ť和SGT-56在43℃下持续增长,而菌株SGT-108 Ť和SGT-109却没有。生长的pH范围也存在可重现的差异。菌株SGT-108 T和SGT-109在缺乏酵母提取物的木炭培养基中生长,表明它们与菌株SGT-39 T和SGT-56以及该菌株不同。军团菌,不需要辅助因子在酵母提取物中发现生长。此外,菌株SGT-108 Ť和SGT-109降解酪蛋白,而通过物种菌株SGT-39表示Ť没有。SGT菌株的脂肪酸组成的差异也表明这些生物代表两个物种。
菌株SGT-39的能力Ť和SGT-108 Ť在生长H. vermiformis表示的这些生物体的最显着的特征之一。然而,这些生物与军团菌属的菌株不同,在这种原生动物中没有达到非常高的细胞内数量。鉴于军团菌在该原生动物中达到10 6 CFU ml -1的数量,菌株SGT-39 T和SGT-108 T仅达到约10 3至2×10 3 CFU ml -1(14)。这些结果使我们推测新生物优先感染其他原生动物,在那里它们产生更致命的感染,或者这些生物建立的慢性感染不会像军团菌那样迅速地压倒原生动物。与许多军团菌相比,这些生物不能在人类淋巴瘤U937细胞系中生长,这可能表明新生物不会感染人类吞噬细胞,正如对L. anisa菌株(14)所提出的那样,但它菌株SGT-39 T和SGT-108 T也可能感染其他人类吞噬细胞系,或者像Rickettsiella一样。,感染其他动物的细胞。几种基因与军团菌的侵袭和存活有关。在巨噬细胞和变形虫中。在这项研究中,我们选择检测所有军团菌属中的mip基因。检测并认为巨噬细胞和变形虫中的军团菌细胞内增殖是必要的(4)dotA基因,参与巨噬细胞中嗜肺军团菌的细胞内生长(37),以及在嗜肺军团菌中发现的traA样基因。(31)并认为对于Acanthamoeba castellani和H. vermiformis。未能检测到任何这些基因的菌株SGT-39 Ť和SGT-108 Ť可能表明SGT菌株不感染吞噬细胞或甚至变形虫。它是,但是,可能的是,菌株SGT-39 Ť和SGT-108 Ť具有其它基因的真核细胞的感染性或检验的基因的序列在新的生物体足以不同到与所使用的引物被检测到。
新生物的非常窄的pH范围也令人惊讶。如果我们假设实验室培养基中新的SGT生物的窄pH范围在很大程度上反映了自然环境中生长的pH范围,我们可以得出这样的结论:这些菌株不能在pH值频繁发生变化的地方生长。此外,这些生物从水中分离,pH值为8.0至8.4,这不允许生物体的生长。结果表明菌株SGT-39 Ť和SGT-108 Ť在生长H. vermiformis导致我们推测,这些生物体通常栖息原生动物,其中细胞内pH将是稳定的和中性附近。
生长温度范围也非常窄,表明生物体不能在含水层中生长,其中温度约为48°C。我们对48°C恢复的分析表明,这些生物可以在SãoGemil水中存活约10小时,但它也表明这些生物(及其推定的宿主)可能来自进入热水并生存的较冷水。在含水层和钻孔过境期间。
来自SãoGemil的新生物代表γ- 变形菌内的深部系统发育分支,与真核生物的严格或兼性细胞内寄生虫结合,并且可能在未知宿主中引起疾病。基于生理学,生物化学和系统发育结果,我们希望将菌株SGT-39呈现为新种属的新种的菌株,我们提出其名称为Aquicella lusitana。我们还认为,应变SGT-108 Ť从SGT-39表示一个新种phenotipically和系统发生学上不同Ť(94%的16S rRNA基因的序列相似性)和相同的属,为此我们建议名称的Aquicella siphonis。
Aquicella(A.qui.cel'la,L.Ñ。水上,水; L. FEMÑ 地窖,腔室或细胞; L. FEMñ Aquicella,从水的小区)。水葫芦形成杆状细胞和细丝。细胞染色革兰氏阴性。没有观察到运动性和鞭毛。细胞不产生孢子。BCYE培养基上的菌落发白,带有粉红色或带蓝色的光泽和磨砂玻璃质地。水葫芦的种类生长温度范围在约30至45°C之间; 该属的菌株需要中性pH才能生长。Aquicella严格需氧和细胞色素氧化酶和过氧化氢酶阴性。脂肪酸是支链。主要的磷脂是磷脂酰胆碱,磷脂酰甘油,磷脂酰乙醇胺和二磷脂酰甘油。Q11是主要的呼吸醌。水痘是化学有机营养的。该属的两个物种仅在含有活性炭的培养基上生长并且需要α-酮戊二酸。酵母提取物可能是也可能不是生长所必需的。有机体在原生动物中生长。该属的种属属于γ-变形菌。种类是A. lusitana。
Aquicella lusitana(lu.si.ta'na; L. fem.n.lussitana,属于Lusitania,伊比利亚西部的罗马省)。A. lusitana形成宽度为0.4至0.7μm,长度为1.8至2.2μm的棒状细胞。最佳生长温度为约37℃,最大生长温度为约43℃,并且在45℃下不生长。生长的最佳pH值在6.5到7.3之间; 在pH 6.0或7.5下不发生生长。主要的脂肪酸是17:0异,一个未知的脂肪酸具有17.495的ECL,和17:1ω9 Ç异。硝酸盐不会还原成亚硝酸盐。Hippurate被水解; 酪蛋白没有水解。生物体在BCYE和Degryse培养基162上生长,调节至pH 6.7并补充有木炭和α-酮戊二酸,并且需要酵母提取物用于生长。它生长在原生动物H. vermiformis但不生长在人类淋巴瘤U937细胞系中。
DNA的摩尔G + C比率为44.9%。在SãoGemil的温泉水中将这种细菌从水中分离出来。类型应变,SGT-39 Ť,已沉积在巴斯德研究所,巴黎,法国的收集,为菌株CIP 107650和在BCCM / LMG细菌收集,根特,比利时,为菌株LMG 21647。
Aquicella siphonis(si.pho'nis,L。gen.n.siphonis,属于管或管)。A.虹吸形成杆状细胞,宽度为0.4至0.8μm,长度为1.9至2.3μm。最佳生长温度为约37℃,最大生长温度为约40℃,并且在43℃下不发生生长。生长的最佳pH值在6.3到7.0之间; 在pH 6.0或7.3下不发生生长。主要的脂肪酸是17:0异,17:1ω9 Çiso和未知脂肪酸,ECL为17.495。硝酸盐不会还原成亚硝酸盐。Hippurate和酪蛋白被水解。生物体在BCYE和Degryse培养基162上生长,调节至pH 6.7并补充有木炭和α-酮戊二酸,并在改良的BCYE上生长,其中酵母提取物被胰蛋白胨替代。它生长在原生动物H. vermiformis但不生长在人类淋巴瘤U937细胞系中。
DNA的摩尔G + C比率为48.3%。在SãoGemil的温泉水中将这种细菌从水中分离出来。类型应变,SGT-108 Ť,已沉积在巴斯德研究所的集合作为应变CIP 107651和在BCCM / LMG细菌收集为菌株LMG 21648。