发布日期:2018-11-07 13:40 来源:活性炭网 作者:活性炭网 浏览数:
抽象 背景 活性炭(AC)是一种常用的吸附剂,可用于人造和生物人工肝装置。 方法 三种天然材料 - 凤凰 (水果), Simmondsia chinensis (荷荷巴)种子和 栅藻 ( Scenedesmus spp )的 日期坑
急性肝功能衰竭(ALF)是一种威胁生命和破坏性疾病,最常发生在没有既往肝病的患者身上。该疾病导致一系列可能导致死亡的其他疾病/并发症。1 ALF与肝功能障碍,肝脏生化指标异常,凝血功能障碍和脑病相关,通常伴有多器官衰竭和死亡。近年来,血液净化系统,例如分子吸附再循环系统,可以去除白蛋白结合(中链脂肪酸,色氨酸及其代谢产物,有毒胆汁酸和胆红素)和水 - 可溶性(氨,苯丙氨酸和酪氨酸)毒素或用于紧急肝移植。2 然而,由于缺乏匹配的供体和移植后通常的并发症,大多数情况下肝移植不易获得。
已经使用几种生物和非生物学方法来开发人造肝脏装置。3活性炭(AC)是人造和生物人工肝(BAL)装置中使用的吸附剂之一。由于其丰富,合理的成本,高孔隙率,有利的血液相容性,高化学和热稳定性,大的表面积和对不同化合物的吸附能力,大多数血液灌流系统使用AC作为吸附剂来去除胆红素。4,5用纳米孔<1个纳米,AC材料的吸附容量分别为朝向胆红素相对较低。6最近,已经报道了几种碳基材料作为新的潜在胆红素吸附剂,旨在提高肝脏支持装置的吸附效率。7,8保持细胞活力和功能的全在病人的床边治疗和落实细胞收容设备仍然是尚未解决的主要挑战。9在细胞外壳装置中,体外肝脏辅助装置是描述所有体外血液治疗措施的装置,其有助于肝脏的不同功能,以试图最小化由于肝功能衰竭导致的衰竭器官的数量,从而延长患者的存活期。体外肝脏辅助装置不能消除疾病的原因,而是留出时间进行肝脏再生和/或为等待肝脏移植的患者提供桥梁,因此代表了可以改善患者预后的有吸引力的替代方案。10通过诱导肝细胞执行肝功能和处理肝衰竭患者的外部循环血浆/血液,可以实现该目标。肝细胞通常在细胞外壳生物反应器中培养,该生物反应器构成BAL装置的基本生物成分。已经在增强体外培养肝细胞方面取得了重大进展,但BAL装置中的基质合成和反应器组装仍然滞后。有限的常规运输,整个反应器的营养梯度,不均匀的接种,低效的固定化和肝细胞的不良生长仅是BAL装置技术目前面临的一些限制。因此,需要新的细胞培养装置设计以改善细胞组分效率。11在这些装置中使用原代肝细胞或肝细胞系。源自猪肝细胞或来自肿瘤细胞系的肝细胞系有时可能产生感染和恶性肿瘤传播。12个人肝细胞可能是细胞体外肝脏辅助装置的未来研究的最佳来源。13
对培养中生长的细胞进行细胞毒性测定是一种广泛使用的方法,用于预测各种化合物对细胞的潜在毒性作用。14有当前正在使用的,像ATP测量,MTT,中性红,膜完整性/ LDH释放,高分子合成,和谷胱甘肽耗竭几种常用的细胞毒性测定法。15 - 17原料,如枣坑,荷荷巴籽和微藻,是廉价的生物质来源。它们含有大量碳水化合物,占组合物的50%以上,灰分含量低。18 - 20然而,几乎没有报道从日期坑,荷荷巴油和微藻原料制备AC。通过化学活化从日期坑制备的AC已用于甲基橙吸附。通过化学活化从荷荷巴种子残留物中制备了18 AC,并研究了AC,粒度和化学试剂等工艺变量的影响。19 AC已经从微藻通过水热碳化和KOH活化处理过程的组合来制备。20
现在广泛使用3D培养系统代替2D(或静态)培养,因为前者代表细胞实际存在于组织中的微环境。研究表明,3D培养细胞的行为更好地概括了体内细胞反应。21 - 24 3D培养系统用于药物发现,癌细胞生物学,干细胞研究,组织工程和其他基于细胞的分析。25 - 27各种细胞系的三维培养物已被用于药物筛选,细胞毒性测定法,和细胞的生物材料相互作用,其中所用的生物材料是胶原蛋白,胶原蛋白-壳聚糖,基质胶,纤维蛋白原矩阵,藻酸盐,PURAMATRIX支架,和聚乙二醇基质。22,24为了检查日期凹坑,霍霍巴种子,以及微藻如在生物反应器BAL细胞载体的AC,HepG2人癌细胞进行了评估,除了THLE2正常肝细胞。原理是原代肝细胞通常在短时间内功能上可行。23此外,在(作为所需的BAL生物反应器)的高细胞密度生物反应器中培养原代肝细胞可能导致缺氧。可以通过剪切应力由于连续流动降低细胞存活力。282D培养中的细胞系不能超过72小时进行研究,因为细胞需要更换培养基或保持静止状态。为了克服这种限制,生物反应器中的3D培养细胞通常生长在依赖于那些细胞(粘附或悬浮)的生长特征的支架,基质或微载体上。28 - 31
在本研究中,测试了来自不同来源的AC从含白蛋白和不含白蛋白的溶液中吸附胆红素。据我们所知,这项研究首次评估了由日期坑,荷荷巴油和微藻制备的AC对胆红素吸附的影响。AC的容量和有效性通常取决于所使用的前体和采用的活化技术。因此,在本报告中,使用原始日期坑,荷荷巴和微藻作为碳前体制备AC,并评估AC对胆红素的选择性吸附。最后,在2D和3D设置中培养的THLE2和HepG2细胞中评估了此处合成的AC的细胞毒性。
收集原始日期坑(当地收集的),荷荷巴种子(Simmondsia chinensis ;埃及天然油,开罗,埃及)和干燥的微藻细胞(Scenedesmus spp .; Algal Oil Company,Manila,Philippines),用去离子水洗涤,干燥,用电动搅拌砂浆(JK-G-250B2; Jingke Scientific Instrument,中国上海)研磨。原料的物理活化在管式炉(GSL-1500X; MTI Corporation,Richmond,VA,USA)中进行,碳化,然后活化。将样品置于坩埚中并保持在炉内。使N 2气体通过10分钟,然后在恒定的N 2流下逐渐升高温度以5℃/分钟的速率直至600℃并在该温度下保持4小时。然后在CO 2气体代替N 2气体的同一炉中在900℃下活化含碳材料。30然后将所制备的AC是使用美国标准测试筛(根据ASTM E-II规范的200-300微米筛目大小),用于在吸附剂实验使用过筛。为了制备AC纳米材料(nano-AC),在RM 100研磨机(Retsch,Haan,Germany)中对AC进行湿磨,然后在-55℃下在冷冻干燥器(Telstar,Terrassa,Spain)中干燥。 0.02毫巴,持续6小时。然后在用于细胞毒性实验之前,使用0.45μm聚四氟乙烯过滤器(Thomas Scientific,Swedesboro,NJ,USA)过滤该材料。
使用扫描电子显微镜(SEM)在3kV加速电压(JSM-5600; JEOL,Tokyo,Japan)检查AC样品的表面形态和能量色散光谱。将AC样品在105℃的热炉中干燥过夜。将样品安装在附着在铝棒上的粘性碳带上,随后用金层溅射涂覆。18用傅里叶变换红外光谱法(Thermo Nicolet Nexus 470; GMI,Ramsey,MN,USA)分析化学结构。对于该分析,将AC样品在110℃下烘箱干燥过夜,储存在加盖的烧瓶中,并在分析之前保持在干燥器中。通过将颗粒与溴化钾粉末(Sigma-Aldrich,St Louis,MO,USA)混合制备测试样品,然后压制成粒料。然后将颗粒置于样品架中并记录波数为400-4,000cm -1的光谱。
使用Zetasizer Nano ZS(Zen360; Malvern Panalytical,Malvern,UK)在25℃下通过动态光散射进行Nano-AC的尺寸分布测量。使用相同的机器在透明的一次性ζ-电池(DTS 1060C)中测量ζ-电位。使用超声将纳米AC粉末悬浮在去离子水(H 2 O)中。16个碳样品通过差示扫描量热法检测(DSC; Q 2000; TA仪器,New Castle的,DE,USA)。将样品以10℃/分钟的加热速率从25℃加热至600℃,氮气流速为50mL /分钟。使用Q50分析仪(TA Instruments)进行热重分析(TGA)。32 - 34 将AC样品以10℃/分钟的加热速率从25℃加热至800℃,氮气流速为40mL /分钟。
白蛋白(分子量66,000g / mol),胆红素(分子量584.7g / mol)和所有其他化学品购自Sigma-Aldrich。所有实验均在使用棕色烧瓶的暗室中进行,以避免毒素的光降解。通过在没有吸附剂的情况下进行对照实验1周来测试制备的溶液的稳定性。通过将30.4g固体胆红素溶解在650mL 0.1M NaOH溶液中制备80μM的胆红素储备溶液。为此,加入26mL 2%(w:v)白蛋白溶液。通过加入PBS使体积达到1L,使最终pH达到7.4。从储备溶液中制备两种稀释度60和30μM。7,32
使用由日期坑,荷荷巴和微藻制备的AC进行批量吸附实验,通过将40mL胆红素 - 白蛋白溶液与特定量的AC:0g(对照),0.1,0.5和0.8g混合用于三种类型的AC中的每一种。 。然后将瓶子保持在37℃的水浴振荡器(Shimadzu,Kyoto,Japan)中以模拟人体温度。6对于所有运行,摇动速度保持恒定在100rpm,其足够高以将AC样品均匀地分散在溶液中。通过紫外 - 可见分光光度法(UV-1800; Shimadzu)在416和279nm的波长下记录读数,以分别评价胆红素和白蛋白浓度。在这些波长下,胆红素消光系数与白蛋白/胆红素摩尔比无关。8,35校准是通过测量胆红素和白蛋白的已知浓度的光密度在它们各自的波长得到的。
两种人细胞系购自美国典型培养物保藏中心(ATCC; Manassas,VA,USA):正常肝细胞系THLE2和肿瘤细胞系HepG2。将THLE2细胞维持在支气管上皮细胞生长培养基(Lonza,Basel,Switzerland)中,补充有热灭活的FBS(HyClone; GE Healthcare,Little Chalfont,UK),终浓度为10%和1%青霉素和链霉素(Thermo) Fisher Scientific公司,沃尔瑟姆,MA,USA),并在加湿的空气0.1%庆大霉素溶液用5%CO 2在37℃下。将HepG2细胞在补充有热灭活的FBS的DMEM(HyClone)中培养至终浓度为10%和1%青霉素 - 链霉素溶液,在含5%CO 2的潮湿空气中在37°C。根据ATCC指南,将细胞在预先涂有胶原蛋白I(2.9mg / mL),纤连蛋白(1mg / mL)和牛血清白蛋白(1mg / mL)的烧瓶中培养在支气管上皮细胞生长培养基中。
将在液氮中冷冻的TH1E2和HepG2细胞在37℃水浴中解冻2分钟。通过将一个小瓶的内容物悬浮在50mL Falcon管中的20mL传播培养基中来除去冷冻培养基。将解冻的细胞在4℃下以1,000rpm离心5分钟。将细胞沉淀重悬浮于增殖培养基(20%DMEM用于HepG2和20%支气管上皮基础培养基用于THLE2)中并接种在预涂T25烧瓶中。将烧瓶在37℃和5%CO 2下孵育2-3天。培养细胞直至它们达到40%-60%汇合,然后使用胰蛋白酶-EDTA溶液解离,重悬于它们各自的培养基中,并使用血细胞计数器(Agar Scientific,Stansted Mountfitchet,UK)计数。使用台盼蓝排除测定法评估细胞活力。21,22台盼蓝(50μL)与50μL的细胞悬浮液混合。然后将该悬浮液(5-10μL)移液到血细胞计数器的细胞计数室中。台盼蓝只穿透死细胞,看起来是深蓝色。在光学显微镜下检测活细胞和死细胞(CX43; Olympus,Tokyo,Japan)。在接种细胞之前测定细胞活力> 90%。
3D培养方法与2D培养一起实施; 前者目前用于BAL装置的研究。使用36个细胞,密度为3×10 5个细胞/ cm 2,体积为250μL细胞培养基/ cm 2培养板。Matrigel matrix(354248; Corning,NY,USA),一种厚凝胶,用于培养细胞。根据制造商的方案进行基质胶的制备,终浓度为5mg / mL和150μLMatrigel/ cm 2培养容器表面。22,24将培养基每2天更换一次。
MTT(Sigma-Aldrich)测定法用于通过测量通过还原MTT的四唑鎓环形成的深蓝色甲product产物来定量线粒体活性。14,17的累积的甲溶解在洗涤剂和在570nm处用分光光度法进行分析。甲amount的量与活细胞的数量成比例。通过向96孔组织培养板的每个孔中加入100μL细胞悬浮液,以5×10 3个细胞/ mL 接种THLE2和HepG2细胞。17,21将培养板培养足够的时间以确保附着和40%-60%汇合。总共250μg/ mL纳米AC被认为是储备溶液,其中每孔加入12.5-62.5μg/ mL的AC浓度。最后一行未用纳米AC(对照)处理。另一行被视为空白(即,仅培养基)。研究了由日期坑,微藻和荷荷巴油产生的纳米AC。将板在37℃,5%CO 2下孵育1,2和3小时。与纳米AC一起温育后,吸出培养基并用新鲜培养基替换。然后,向每个孔中加入总体积为100μL的MTT溶液(10μL),并在37℃,5%CO 2下孵育3小时。。随后,温和地除去含有MTT的培养基并用二甲基亚砜(每孔100μL)代替以混合甲crystals晶体直至溶解。20分钟后,使用微量滴定板读数器(XL800; BioTek,Winooski,VT,USA)在570nm处测量每个孔的吸光度。细胞活力计算为未处理对照值的百分比(即,处理细胞的光密度/对照的光密度)。21
苏木精和伊红是用于评估细胞结构的标准组织学染色。将培养的细胞用62.5μg/ mL纳米AC处理24小时,用冰冷的甲醇:乙醇(1:1)固定15分钟,并风干。盖玻片在蒸馏水中快速洗涤六次。将细胞用苏木精溶液染色2分钟,然后在H 2 O中漂洗,然后用曙红复染10秒。盖玻片用乙醇系列(70%,96%和100%)冲洗,空气干燥,用DPX(二苯乙烯,增塑剂,二甲苯; Sigma-Aldrich)固定,并在明视野显微镜下观察(OLYMPUS,IX83研究倒置显微镜) 2DECK,Tokyo,Japan)配备相机(DP73; Olympus,Tokyo,Japan)。37
对于荧光显微镜检查,通过胰蛋白酶消化收获THLE2和HepG2细胞,并将3×10 5个细胞/ mL铺在置于10mm培养皿中的无菌盖玻片上。盖玻片上的细胞最初在其各自的培养基(1L /盖玻片)中在37℃,5%CO 2培养箱中包含24小时。然后用62.5μg/ mL纳米-AC处理细胞培养物并孵育24小时。用DPBS(Sigma-Aldrich)洗涤细胞两次,然后在室温下在4%多聚甲醛(Sigma-Aldrich)中固定10分钟。28,37洗涤细胞,并用0.1%Triton X-100透化处理5分钟,荧光素isothiocya-内特(FITC)标记的鬼笔环肽加入,并保持温育40分钟。38 -用DPBS和0.1%Triton X-100洗涤40个细胞4分钟。将样品用DAPI-Fluoroshield(Sigma-Aldrich)固定10分钟,然后洗涤以除去过量的DAPI。40最后,用DPX封固剂将盖玻片固定在磨砂玻片上。类似地,使3D培养的细胞在基质胶和胶原中生长10天。24,38的Matrigel充当细胞生长和模仿人体内的条件的框架。与正常培养相比,3D培养的生长速度要慢得多,特别是在正常细胞的情况下。将细胞自身附着于基质胶,并用鬼笔环肽-FITC和DAPI-Fluoroshield荧光染料染色,使用与2D培养细胞相同的方法。
用t-测试进行数据分析(双尾分布,显着性,P <0.05)。在纳米-AC施用后的三个时间点收集读数。
图1显示了原始日期 - 坑粉末和由日期坑,荷荷巴种子和微藻产生的AC的SEM图像。它们各自的表面形态之间存在显着差异。活化前日期坑粉末的SEM图像显示没有孔(图1A)。活化1小时后形成直径约5μm的孔(图1B和C)。日期坑AC表现出均匀,均匀,高度多孔且明显的蜂窝结构阵列,表明毒素被捕获和吸附的可能性。图1C的放大图像示出了形成孔壁的线状结构阵列,因此大大增加了表面积。图1D-F显示荷荷巴种子AC图像,其显示几乎均匀的孔隙结构,具有通道和大孔和中孔形状的大孔。每个通道包含大量中孔,如图1F的放大图像所示。图1G-I显示了展示纤维状结构的微藻AC图像。纤维相互连接,彼此之间有空腔。在活化过程中在碳的外表面上产生的孔主要是由于挥发性物质的释放。这可归因于插入碳基质的金属原子的存在,导致碳原子层之间的空间变宽。
在900℃活化温度下从三种前体 - 日期坑,荷荷巴种子和微藻 - 获得的AC元素分析结果如表1所示。,显示碳,氢,氮和氧的质量百分比。发现了少量其他元素,但未在表中显示,如钠,钾,钙,镁,磷和铁。荷荷巴籽AC的碳和氮含量最高。但是,氧含量最低。此外,微藻AC的碳和氮含量最低。日期坑AC显示碳,氢,氮和氧含量值分别为49.82%,4.12%,4.02%和28.18%。这是由于碳化期间挥发物的释放导致非碳物质的消除和碳的富集。18,41
不同植物材料产生的AC的元素分析
| 吸附剂 |
质量(%)
|
|||
|---|---|---|---|---|
| 碳 | 氢 | 氮 | 氧 | |
| 日期坑AC | 59.82 | 4.12 | 4.02 | 28.18 |
| 荷荷巴籽AC | 65.65 | 7.72 | 10.39 | 13.10 |
| 微藻AC | 53.58 | 4.91 | 3.30 | 25.71 |
缩写: AC,活性炭。
图2显示了从波数范围400-4,000cm -1的日期坑,荷荷巴种子和微藻合成的三个AC样品的傅里叶变换红外光谱。三个AC样品显示出几乎相似的具有强度变化的官能团。由于物理活化,原料的碳化和活化导致O 2和H基团的分解。41 - 43氧化学键到外围个碳原子,从不同的官能团产生。18波段约3,400 cm -1归因于OH键的不对称和对称伸展振动,并表明在AC表面上存在羧酸。在2,300-2,350cm -1处观察到的其他峰归属于脂肪族带。1,400-1,700cm -1处的峰归因于C-O的共轭拉伸,C = C,C = O的羰基。日期坑AC显示出约1,030cm -1的宽带,这归因于C-O伸展。这表明存在酸,醇和酚。650 cm -1处的带是由于平面环变形引起的。
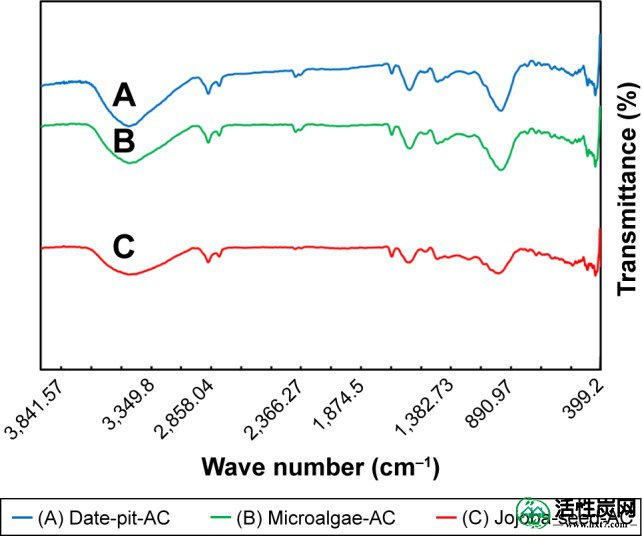
傅里叶变换红外光谱。
注:(A)日期坑活性炭(AC); (B)微藻活性炭; 和(C)荷荷巴籽活性炭。
图3A显示了由日期 - 去离子水(H 2 O)分散体产生的纳米AC的尺寸分布。它具有65-350nm的大尺寸分布,并且大多数颗粒<200nm,平均尺寸为135nm。图3B显示了在H 2 O分散体中由荷荷巴种子产生的纳米AC的尺寸分布。它具有窄的尺寸分布,平均尺寸为284nm。图3C显示了在H 2 O分散体中由微藻产生的纳米AC的尺寸分布。它具有170-700nm的大尺寸分布,平均尺寸为344nm。18, 40 图3A表明,大多数颗粒是<200nm时,以135纳米的平均尺寸。图3B显示窄尺寸分布,平均尺寸为284nm。图3C显示170-700nm的大尺寸分布,平均尺寸为344nm。18, 40
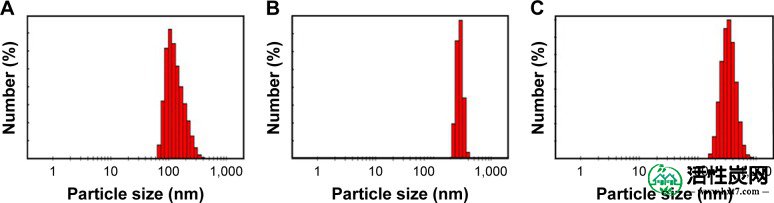
纳米材料的尺寸分布直方图。
注释:(A)日期坑活性炭,(B)荷荷巴籽活性炭,和(C)分散在H 2 O中的微藻活性炭。
图4显示对于日期坑纳米AC,ζ-电位值为-10.1mV,对于荷荷巴籽纳米AC为-26.3mV,对于H 2 O悬浮液中的微藻纳米AC为-42.7mV。日期坑纳米AC在表面上具有小的负电荷,这表明随着时间进入簇中聚集的稳定性和亲和力较小,而由于粒子之间的排斥力,所产生的微藻纳米AC具有高稳定性和均匀性。这由颗粒的巨大负表面电荷表明。通过提高纳米AC在悬浮液中的稳定性,可以增强各种毒素分子的吸附和去除。16, 44, 45
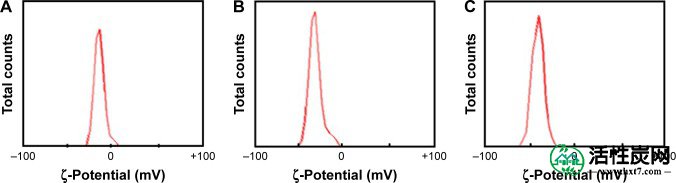
ζ-(A)日期坑活性炭,(B)荷荷巴籽活性炭和(C)分散在H 2 O中的微藻活性炭纳米材料的电位。
为了确定活化过程中原始植物材料的一般分解特性,对样品进行TGA。图5A显示了N 2中日期坑,荷荷巴种子和微藻的TGA曲线气氛以10°C /分钟的加热速率。三个样品的热分解分三个阶段进行。在日期坑的第一阶段,观察到原料的急剧重量损失:在35℃-100℃下约12%。由于主要由于水的蒸发释放出大量挥发性,第一阶段显示出显着的重量损失。在100℃-450℃下获得的第二阶段为约10%,其中碳化过程开始并且主要是半纤维素和纤维素部分分解。在较高温度(450℃-800℃)下,重量损失是由于木质素分解。由于样品的脱水,荷荷巴种子的TGA曲线显示出高达250℃的重量损失约8%。在下一阶段,观察到高达450°C的渐进和显着的体重减轻,2,CH 4,H 2,H 2O)。在第三阶段,木质素开始分解并有助于减肥。此外,来自第一阶段的残余挥发性进一步释放,但留下了碳。由于检测到的微藻细胞已经干燥,微藻的TGA曲线在第一阶段显示出小的减少。33,34然后,从140℃观察到600℃,其中大多数的有机材料被分解,因为微藻是不是在组合物中的木质纤维,而是由脂类,蛋白质,核酸的逐步和显著体重减轻,和碳水化合物。18第三阶段> 600℃表明固体残余物中的碳质物质开始分解。从TGA结果可以看出,> 800℃的温度更适合于原料的热解和活化。33,34
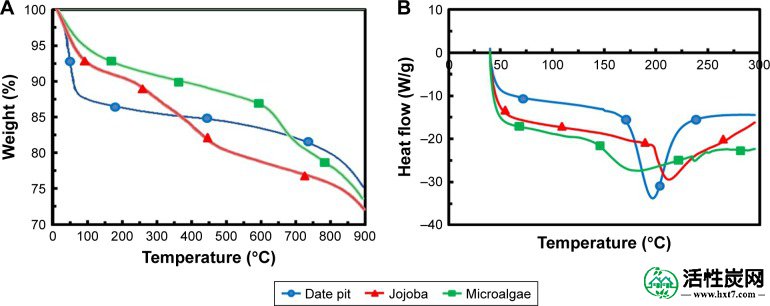
(A)TGA和(B)原始植物材料日期坑,荷荷巴油和微藻的DSC曲线。
缩写: TGA,热重分析; DSC,差示扫描量热法。
图5B显示DSC曲线。这些显示第一阶段的温度略有下降,因为样品需要加热以蒸发剩余的水。33日期坑和荷荷巴种子的DSC分别显示在约200℃和212℃的谷,其中半纤维素和纤维素分解并产生大量有机化合物,如焦油,酮和甲醇,它们会通过吸附大量的有机化合物而蒸发。热。然而,微藻在约180℃时到达其谷,因为脂质,蛋白质,核酸和非纤维素碳水化合物在较低温度下分解。18
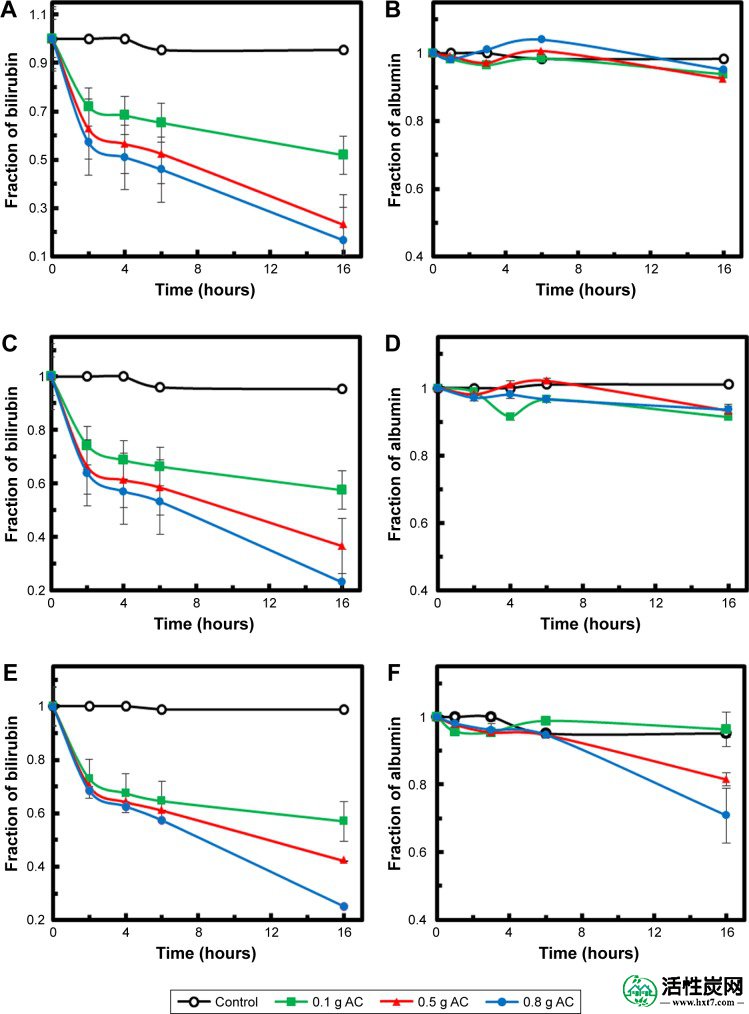
图6A,C和E分别显示了在日期 - 坑AC,荷荷巴种子AC和微藻AC中的胆红素吸附,使用0.1,0.5和0.8g各自在胆红素 - 白蛋白的初始胆红素浓度为30μM时解。对照实验中胆红素浓度的显着下降( P<0.05),没有吸附剂,证明下降主要是由于吸附。胆红素的量随着AC量的增加而增加,并且观察到胆红素的最高吸附率在最初的4小时内发生。6, 7吸附通常表现出两个阶段。在初始阶段,外部表面吸附占主导地位,其中胆红素从溶液扩散到吸附剂的外表面。该步骤主要受表面吸附动力学速率控制。一旦外表面已经被胆红素分子饱和,第二阶段开始,其中内部扩散变得更重要并且经常导致吸附速率的稳定降低。7,35
溶液中残留的胆红素和白蛋白的时间依赖性。
注:不同浓度的(A和B)日期坑AC,(C和D)荷荷巴籽AC和(E和F)微藻AC。
缩写: AC,活性炭。
图6B,D和F.图中显示了相同溶液中的白蛋白浓度,分别使用日期坑AC,荷荷巴籽AC和微藻AC,分别使用0.1,0.5和0.8g。清楚地证明,在AC存在下,白蛋白浓度的下降是微不足道的。这表明合成后的AC样品能够从胆红素 - 白蛋白复合物中剥离胆红素分子,而不是完全吸附复合物。为了成功去除胆红素,AC应该能够与白蛋白上的弱结合位点竞争未结合的胆红素。具体地,可以在含氧基团(即,在AC上)和胆红素分子之间形成静电和疏水相互作用和氢键。由于AC由大孔产生的高表面积,吸附效率得到提高。在胆红素和白蛋白的混合溶液中胆红素的选择性吸附基于这些分子的物理尺寸的差异。因此,约2nm的胆红素分子能够通过大孔进入AC并固定在其内表面上,留下白蛋白,因为白蛋白分子远大于孔径。46,47胆红素分子到AC的内表面的结合比对它们的外表面强,由于限制效应和胆红素分子的高密度。这是合成后AC的一个重要特征,证明了其在不去除有用分子和物质的情况下从血液中去除胆红素的重要性。
为了比较三种吸附剂的性能,观察到轻微的差异,其中日期坑AC显示出胆红素随时间的最高吸附(图6A)。然而,荷荷巴籽AC和微藻AC显示出几乎相似的趋势(图6C和E)。这种变化可归因于表面形态的差异,如图1所示。图7显示了胆红素的初始浓度(C 0,mg / L)与最终浓度(C eq,mg / L)。最初,测试了三种不同浓度(80,60和30μM)的胆红素,并且所有样品的结果显示胆红素减少。然而,日期坑AC比荷荷巴籽AC和微藻-AC具有更大的吸附能力。荷荷巴种子AC显示出最少的胆红素去除,并且微藻AC显示出适度的吸附速率。
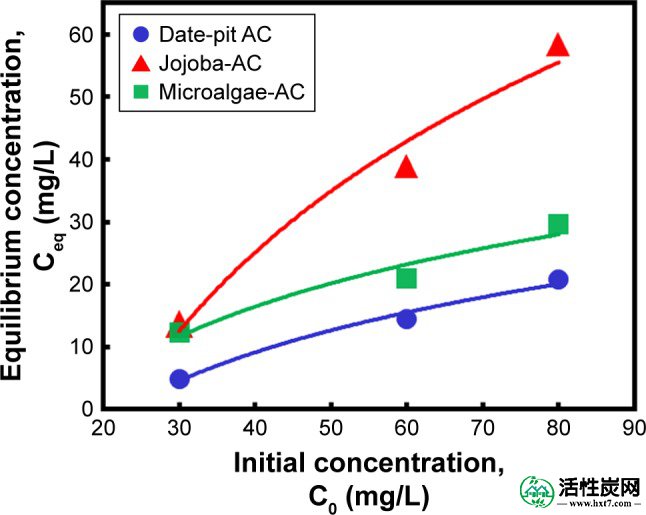
初始胆红素浓度对最终平衡浓度的影响使用0.8 g日期AC AC,荷荷巴种子AC和微藻AC在37°C和pH 7.4。
缩写: AC,活性炭。
图8A和B显示了日期坑AC,荷荷巴籽AC和微藻AC的Langmuir和Freundlich线性等温线图。Langmuir和Freundlich等温线通常用于确定最合适的吸附机制的等温线。计算在平衡时吸附在AC上的胆红素量(q eq,mg / g):
其中,q eq是平衡时吸附的溶质量,C 0是初始胆红素浓度,C eq是16小时后溶质在溶液中的平衡浓度,Vsample是样品的体积,“m”是质量的使用的吸附剂。Langmuir等温,在所描述的等式2,假定吸附的分子间引力的力是可以忽略不计,并且当一个分子占据一个位点,没有进一步的吸附发生在该位点:35,48
其中q o是最大吸附容量,“b”是与吸附自由能相关的常数。通过绘制图1 / q e对1 / C eq,可以确定Langmuir常数,并且分别根据截距和斜率确定q o和“b” 的值。图8中所示的结果用于确定q eq和C eq,然后将其用于确定等温线参数q o和“b”(表2)。
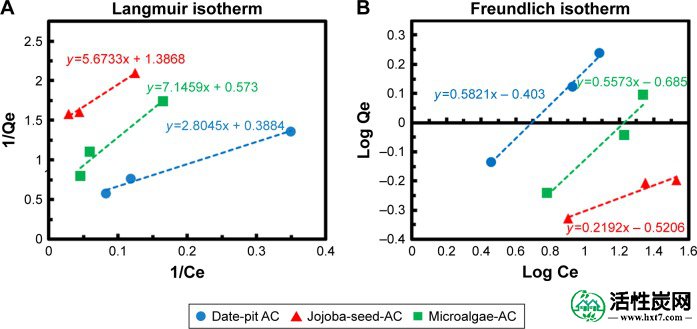
使用(A)Langmuir模型和(B)Freundlich模型的日期坑AC,荷荷巴籽AC和微藻AC的线性等温线图。
缩写: AC,活性炭。
在37℃和pH 7.4下天然材料上胆红素吸附的等温线参数
| 等温线 | 参数 | 日期坑AC | 荷荷巴籽AC | 微藻AC |
|---|---|---|---|---|
| 朗缪尔 | b *(L / mg) | 0.1249 | 0.2456 | 0.0815 |
| q o #(mg / g) | 2.72 | 0.719 | 1.741 | |
| R 2 | 0.9931 | 0.9917 | 0.9533 | |
| 符合Freundlich | ķ ˚F § | 0.5797 | 0.5026 | 0.5573 |
| 1 / n§ | 0.5821 | 0.219 | 1.9312 | |
| R 2 | 0.9960 | 0.9547 | 0.9465 |
笔记:
缩写: AC,活性炭。
另一方面,Freundlich等温线,如公式3所示,描述了非理想和可逆吸附,应用于多层吸附,在非均匀表面上具有不均匀的吸附热和亲和力分布:48
其中k f和“n”是Freundlich参数,它们可以分别从log q eq对log C eq的直线的斜率和截距确定。48确定的两个等温线的参数如表2所示。决定系数(R 2衡量Langmuir和Freundlich模型的拟合精度水平,接近统一。这表明两种模型都能很好地描述吸附过程。然而,Langmuir模型更合适。结果表明,日坑AC的最大吸附量为2.72 mg / g,高于荷荷巴籽AC和微藻AC的吸附量,分别为0.719和1.74 mg / g。
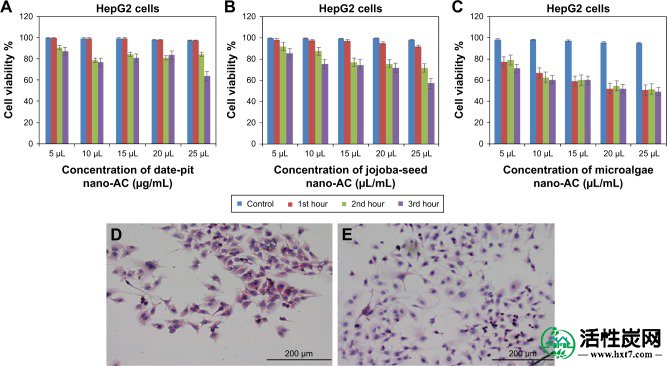
正常肝细胞(THLE2)和人肝细胞癌细胞系HepG2用于评估合成的AC的体外细胞毒活性。将THLE2和HepG2细胞与12.5-62.5μg/ mL日期 - 坑AC,荷荷巴 - 种子AC或微藻AC一起温育3小时。通过MTT测定确定细胞活力。由于琥珀酸脱氢酶的作用,MTT的减少主要发生在线粒体中,因此提供线粒体功能的测量,其中只有活细胞能够有效地代谢染料并产生紫色甲,其与紫杉甲酸的量成比例。 viablility。18,40
图9A-C显示使用MTT测定法与日期 - 坑,荷荷巴 - 种子和微藻纳米AC孵育的THLE2细胞的细胞存活率结果。与未处理的对照相比,观察到细胞活力的最小降低,并且与孵育时间成比例。例如,用日期 - 坑纳米 - AC处理的THLE2细胞在第三小时显示75%的存活率,而荷荷巴种子和微藻纳米AC在相同的暴露时间分别显示45%和25%的存活率。日期坑纳米AC的生长抑制为25%,微藻和荷荷巴籽的生长抑制为70%。图10A-C表明,与对照细胞相比,纳米AC处理的HepG2细胞的细胞活力降低。例如,日期坑纳米AC在第三小时显示出约60%的活力,而荷荷巴籽和微藻纳米AC显示出约40%的活力。两种细胞系之间在对纳米AC样品的敏感性方面存在细微差异。THLE2和HepG2细胞的增殖速率之间的差异可归因于两种细胞系对纳米AC的不同摄取机制。40与施用可以归因于在颗粒尺寸和表面电荷(差值的不同纳米AC产品一起的变化图3和AND44)。44此外,MTT测定似乎更敏感,这可归因于测定主要基于线粒体中MTT的酶促转化和/或线粒体内产生的活性氧物质也可能具有受损的线粒体组分。40
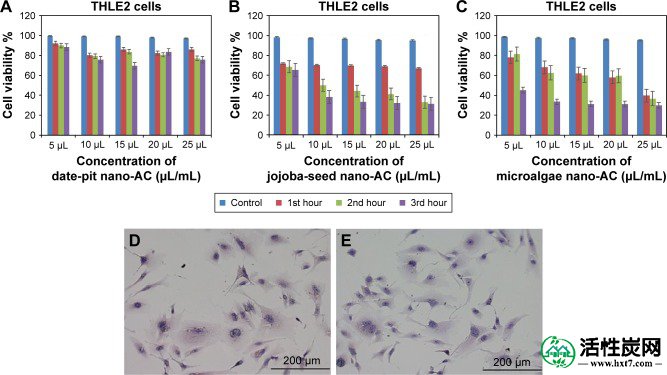
MTT法检测THLE2细胞的活力。
注意:分别在(A - C)1小时,2小时和3小时暴露于纳米AC后。提出了三个独立实验的方法(P<0.05)。用苏木精和曙红染色的活细胞的形态学分析。(D)控制未处理的THLE2细胞; (E)用日期坑纳米AC处理的THLE2细胞。
缩写: nano-AC,活性炭纳米材料。
MTT法检测HepG2细胞的活力。
注意:分别在(A - C)1小时,2小时和3小时暴露于纳米AC后。提出了三个独立实验的方法(P<0.05)。用苏木精和曙红染色的活细胞的形态学分析。(D)对照未处理的HepG2细胞; (E)用日期坑纳米AC处理的HepG2细胞。
缩写: nano-AC,活性炭纳米材料。
图9D和E以及10D和E显示用苏木精和曙红染色的THLE2和HepG2细胞,其中细胞核呈紫色,而细胞质呈粉红色。细胞主要聚集,个体细胞呈多边形。HepG2细胞核小于THLE2细胞核(图9D和E)。暴露于62.5μg/ mL日期坑纳米AC 24小时后,THLE2细胞未发现任何细胞凋亡活性.HepG2细胞表现出细胞凋亡活性,其中是一种特征性的癌细胞应激信号 .49
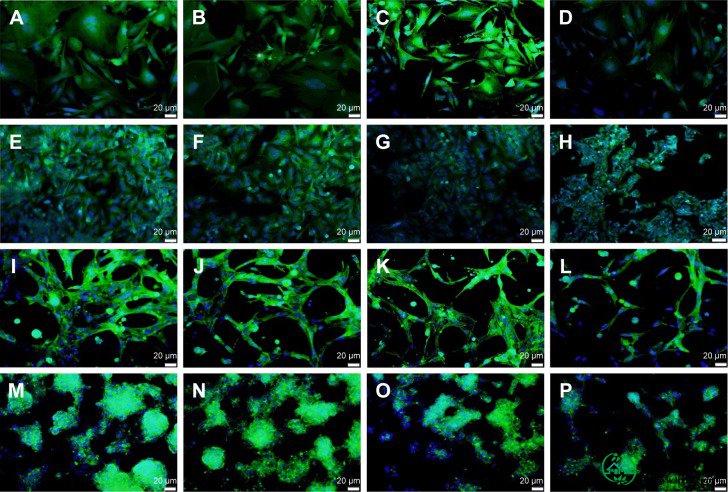
用DAPI-Fluo-roshield和鬼笔环肽-FITC荧光染料染色THLE2和HepG2细胞(图11)。DAPI是一种荧光标签,与细胞核DNA中富含AT的区域强烈结合,因为它可以穿过完整的核膜,并呈现蓝色荧光。另一方面,鬼笔环肽-FITC结合细胞骨架组分,即肌动蛋白丝,其直接位于质膜下面,并显示绿色荧光。38 - 40 图11的2D和3D的显示荧光显微镜培养与日期坑,荷荷巴籽,和微藻纳米-AC处理THLE2和HepG2细胞。肌动蛋白细胞骨架丝的完整性和分布受到应用的纳米AC处理的轻微影响。40 HepG2细胞的形态学变化也比正常THLE2细胞更明显。
荧光显微镜。
注释:(A - D)2D培养的THEL2细胞; (E - H)2D培养的HepG2细胞; (I - L)3D培养的THEL2细胞; (M - P)3D培养的HepG2细胞。(A,E,I,M)对照,(B,F,J和N)用日本坑纳米AC处理,(C,G,K和O)用荷荷巴籽纳米AC处理,和(D,H,L和P)用微藻纳米AC处理24小时。肌动蛋白细胞骨架绿色,细胞核蓝色,鳞片20毫米。
缩写: nano-AC,活性炭纳米材料。
为了开发用于胆红素解毒的新型吸附剂,选择三种植物材料作为AC的合成前体:日期坑,荷荷巴种子和微藻。结构和形态分析显示三种新生产的AC材料之间存在差异。然而,所有开发的AC材料都显示出具有大表面积的多孔结构。此外,它们都显示出优异的吸附质量,包括对胆红素的高吸附能力和对胆红素对白蛋白的高选择性。这些独特的性质清楚地显示了AC在从血液中滤出胆红素而不损失任何有用的血液成分的有利能力。Langmuir和Freundlich模型拟合了平衡实验数据,Langmuir等温平衡模型显示了更好的拟合。结果表明,日期坑AC比荷荷巴籽AC和微藻AC具有更强的吸附能力。此外,对正常肝细胞(THLE2)和癌性肝细胞(HepG2)的体外MTT测定表明,与其正常对应物相比,纳米AC对HepG2细胞的存活率具有更强的作用。