发布日期:2018-11-12 09:39 来源:活性炭网 作者:活性炭网 浏览数:
背景 来自稀酸预处理的生物质预水解产物含有大量用于生物燃料生产的可发酵糖。 然而,羰基降解化合物对发酵微生物具有严重的毒性。 已经提出呋喃(例如糠醛和羟甲基糠醛),脂
木质纤维素生物质具有可持续生产生物燃料的巨大潜力[ 1 ]。分解生物质不顺应,稀释酸通常用来预处理生物质和提高纤维素无障碍用于随后的酶水解[ 2,3 ]。在稀酸预处理后,半纤维素可以在预水解产物中水解成单糖,并可用于进一步生物燃料的生产[ 4 ]。然而,已经在稀酸预处理中,这阻碍微生物发酵[已产生相当量的抑制剂的5 - 9 ]。生物质衍生的抑制剂包括糠醛,羟甲基糠醛(HMF),脂肪酸和酚类化合物[10,11 ]。几个研究已经集中于潜在抑制剂[的识别12,13 ]。陈等人。开发了一种HPLC方法,用于量化玉米秸秆水解产物中的32种脂肪酸,芳香酸,醛和酚类化合物[ 14 ]。Sharma等人。用HPLC-MS / MS表征生物质预水解产物中40种潜在的酸抑制剂[ 12 ]。克林克等人。据报道,碱性处理的小麦秸秆水解产物(包括酸,呋喃和苯酚)产生了26种降解产物[ 13]。虽然已经做出了重大努力来确定微生物发酵的潜在抑制剂,但没有一种化合物被确定为主要的抑制剂[ 15 ]。糠醛和HMF含量已被建议是预水解产物的毒性的重要指标,但它们不是主要的抑制剂[ 4,16 ]。芳族醇(儿茶酚和松柏醇)和芳族醛(4-羟基苯甲醛和丁香)也被发现抑制其生长和发酵大肠杆菌 LY01 [ 17,18 ],以及它们的毒性直接与疏水性[ 19]。实际上,醛和酮通常被认为是微生物的主要有害化合物。例如,Ando等人。量化了杨树水解产物中的12种芳香族降解化合物,并研究了其对酵母发酵的影响[ 20 ]。结果表明,醛和酮比相应的酸和醇更具抑制性。因此,在生物燃料发酵中迫切需要在预水解产物中鉴定和解毒醛和酮。
几种方法已被提出,以减轻在生物质水解产物或prehydrolysates抑制剂的负面影响,包括灰过量[ 21],阴离子交换树脂处理[ 22 ],活性炭(AC)[ 23,24 ],亚治疗[ 25 ],用漆酶和真菌处理[ 25 ]。加灰过量已被建议是最有效的解毒的方法之一[ 26,27 ]。碱性条件有利于醛和酮之间的羟醛缩合反应,和羰基化合物的氧化有可能减轻它们的毒性[ 28 - 30]。马丁等人。观察到过量沉淀部分降低了糠醛,HMF和酚类化合物的浓度,导致酵母发酵中乙醇产量从0.38增加到0.52 g g -1 [ 31 ]。虽然过量活化促进了酵母发酵,但由于剩余的抑制性化合物和梭菌的高灵敏度,丙酮 - 丁醇 - 乙醇(ABE)发酵仍然受到限制[ 32 ]。
与化学解毒方法相比,AC通过物理吸附去除了抑制剂[ 33 ]。龚等人。据报道,与pH调节和离子交换树脂相比,AC 在甘蔗渣水解产物的酵母发酵中提供了相当的生产力(0.40 g L -1 h -1)[ 34 ]。Lu等人。发现AC显着去除了水解产物中的大部分呋喃和酚类化合物,但丁醇产量只能提高到对照的59.2%[ 32 ]。王等人。AC解毒后木糖醇产量提高20%[ 35]。比利亚雷亚尔等人。用AC解毒的预水解产物进行发酵; 然而,最高生产力仅达到参考发酵的37%[ 36 ]。在我们的初步研究中,观察到单独的过量处理和AC处理不能使预水解产物与糖梭菌(Clostridium saccharobutylicum)发酵。然而,用顺序过量和AC方法处理的预水解产物是可发酵的。
在该研究中,使用没有衍生化的GC / MS来分析过量和AC解毒后杨树预水解产物中的组成变化。使用C. saccharobutylicum检查解毒的预水解产物的ABE发酵能力。用二氯甲烷(DCM)进行液 - 液萃取以从潜水解产物中分离潜在的抑制剂。假设过量给药和AC治疗不仅去除了一些常见的抑制剂,而且还选择性地消除了一些特异性抑制剂。还假设AC由于其疏水性而更有效地去除酚酸,并且由于碱催化的醛醇缩合反应,过量吸附在去除某些二醛和二酮方面更具选择性。因此,需要组合方法来对用于ABE发酵的预水解产物进行解毒。还比较了酵母和C. saccharobutylicum之间的解毒预水解产物的发酵能力。预计该研究将通过过度表达进一步促进对生物质预水解产物中潜在抑制剂和解毒机制的理解。
通过GC / MS测定从杨树预水解产物中提取的潜在抑制剂。鉴定了来自未处理的预水解产物的相应的46种抑制性化合物(图 1a)及其保留时间(RT),质荷比(m / z)和浓度(表 1))。抑制性化合物可分为三组。第一组(RT:4-13分钟)是呋喃衍生物(例如糠醛,2,5-呋喃二甲醛和HMF)和脂族衍生物(2,5-己二酮和3-己烯-2-酮)。首先在生物质预水解产物中报道了作为二醛和二酮的2,5-呋喃二甲醛和2,5-己二酮。第二组(RT:13-24分钟)是芳族单体(例如香草醛,丁香醛和(4-羟基-3,5-二甲氧基苯甲酰基) - 乙醛)。第三组(RT:24-37分钟)是芳香族二聚体(例如4-羟基苯基3,4,5-三甲氧基苯甲酸酯和丁香醛),它们的浓度显着低于第一组和第二组化合物(1-10%) 。它们相应的化学结构和片段模式显示在附加文件1中:无花果。S1-S46。
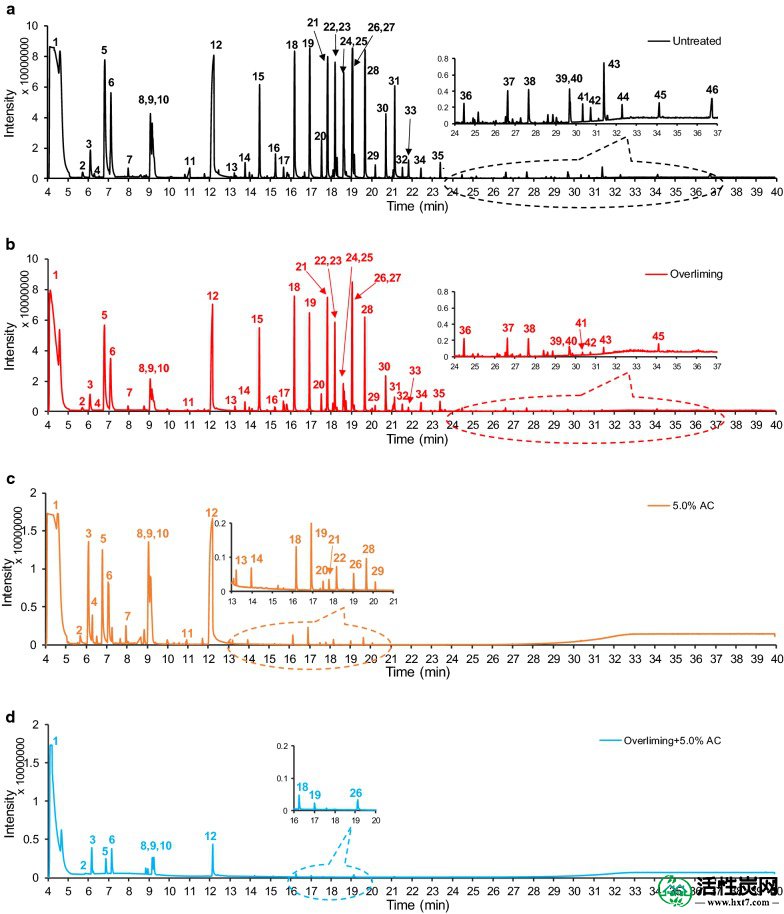
用不同解毒方法处理的预水解产物的TIC-GC / MS色谱图。一个未处理prehydrolysates,b过度石灰; c5%AC; 和d连续过度显示和5%AC
过量和AC解毒对抑制剂去除的影响
| GC峰值 | 化合物名称 | RTa(分钟) | M / Z | 抑制剂浓度b(mg L -1) | ||||
|---|---|---|---|---|---|---|---|---|
| 未处理 | 过量石灰 | 5.0%AC | 过量+ 2.5%AC | 重叠+ 5.0%AC | ||||
| 呋喃衍生物 | 4444.3 | 1078.6 | 995.1 | 897.3 | 408.7 | |||
| 1 * | 糠醛 | 4.089 | 96 | 3360.9 | 736.8 | 721.8 | 789.3 | 378.4 |
| 2 * | 2-乙酰基呋喃 | 5.706 | 110 | 3.3 | 0.9 | 0.9 | 0.9 | 0.8 |
| 5 * | 5-甲基 | 6.794 | 110 | 156.3 | 27.5 | 16.8 | 25.3 | 1.9 |
| 7 * | CYCLOTENE | 7.965 | 112 | 3.8 | 1.0 | 1.7 | 0.7 | NA |
| 8 ** | 2,5-Furandicarboxyaldehyde | 9.063 | 124 | 148.8c | 29.9 c | 53.6 c | 11.6 c | 7.1 c |
| 9 ** | 2-呋喃基羟甲基酮 | 9.15 | 126 | 88.4 c | 59.5 c | 20.3 c | 34.1 c | 5.9 c |
| 10 * | 5-乙基呋喃-2-甲醛 | 9.226 | 124 | 57.3 | 6.2 | 17.6 | 4.4 | 3.1 |
| 12 * | 羟甲基糠醛 | 12.199 | 126 | 625.5 | 216.8 | 162.4 | 31.0 | 11.6 |
| 脂肪族衍生物 | 26.8 | 11.2 | 22.3 | 7.2 | 5.2 | |||
| 3 * | 2,5-己 | 6.094 | 114 | 24.9 | 10.4 | 20.5 | 7.2 | 5.2 |
| 4 ** | 3-己烯-2-酮 | 6.286 | 98 | 1.9 d | 0.8 天 | 1.9 d | NA | NA |
| 芳香族单体 | 1198.8 | 383.5 | 17.0 | 48.2 | 4.5 | |||
| 6 * | 苯酚 | 7.109 | 94 | 68.2 | 16.7 | 5.3 | 5.1 | 2.7 |
| 11 * | 苯甲酸 | 11.007 | 122 | 74.9 | 3.8 | 4.7 | 0.4 | NA |
| 13 * | 3'-甲氧 | 13.211 | 150 | 5.6 | 2.1 | NA | 0.8 | NA |
| 14 * | 3,4,5-三羟基苯 | 13.74 | 154 | 6.4 | 1.7 | 0.4 | 0.2 | NA |
| 15 * | 香兰素 | 14.458 | 152 | 72.8 | 25.8 | NA | NA | NA |
| 16 *** | Homovanillin | 15.263 | 166 | 17.0 e | 1.9 e | NA | NA | NA |
| 17 * | Acetovanillone | 15.636 | 166 | 10.3 | 9.2 | NA | 0.1 | NA |
| 18 * | Guaiacylacetone | 16.188 | 180 | 205.5 | 73.5 | 2.0 | 12.8 | 0.9 |
| 19 ** | 1-(4-羟基-3-甲氧基苯基)丙烷-1,2-二酮 | 16.942 | 194 | 121.0e | 20.3 e | 2.1 e | 4.9 e | 0.2 e |
| 20 *** | 1-(3,4,5-三羟基苯基)丙烷-1,2-二酮 | 17.522 | 196 | 23.1 e | 9.8 e | 0.2 e | 1.0 e | NA |
| 21 * | 丁香 | 17.826 | 182 | 110.0 | 36.3 | 0.3 | 1.7 | NA |
| 22 *** | Hydroxypropiovanillone | 18.189 | 196 | 83.4 e | 41.2 e | 0.7 e | 3.5 e | NA |
| 23 ** | Homosyringaldehyde | 18.29 | 196 | 9.7 f | 0.9 f | NA | 0.1 f | NA |
| 24 ** | 1-羟基-3-(4-羟基-3-甲氧基苯基)丙-2-酮 | 18.617 | 196 | 0.7 e | NA | NA | NA | NA |
| 25 * | 乙酰丁香酮 | 18.653 | 196 | 57.8 | 27.0 | NA | 0.2 | NA |
| 26 * | Syringylacetone | 19.055 | 210 | 88.5 | 29.7 | 0.3 | 9.5 | 0.7 |
| 27 * | 1-(4-羟基-3-甲氧基苯基)-2-丁酮 | 19.142 | 194 | 11.3 e | 2.1 e | NA | NA | NA |
| 28 *** | 1-(4-羟基-3,5-二甲氧基苯基)丙烷-1,2-二酮 | 19.672 | 224 | 104.8f | 15.4 f | 0.8 f | 5.7 f | NA |
| 29 *** | 1-羟基-1-(4-羟基-3,5-二甲氧基苯基)-2-丙酮 | 20.179 | 226 | 6.7 f | 4.4 f | 0.2 f | 0.3 f | NA |
| 30 *** | 2-羟基-1-(4-羟基-3,5-二甲氧基苯基)丙-1-酮 | 20.701 | 226 | 37.5 f | 29.2 f | NA | 1.5 f | NA |
| 31 *** | 2-羟基-1-紫丁香 - 乙酮 | 21.14 | 226 | 59.7 f | 23.7 f | NA | 0.4 f | NA |
| 32 *** | 1-(3,4,5-三甲氧基苯基)-1,2-丙二酮 | 21.517 | 238 | 4.9 f | 2.8 f | NA | NA | NA |
| 33 *** | (4-羟基-3,5-二甲氧基苯甲酰基) - 乙醛 | 21.822 | 224 | 9.5 f | 0.4 f | NA | NA | NA |
| 35 *** | 1-(4-羟基-3,5-二甲氧基苯基)戊烷-1,2-二酮 | 23.388 | 252 | 9.5 f | 5.4 f | NA | NA | NA |
| 芳香二聚体 | 45.9 | 14.2 | NA | NA | NA | |||
| 34 *** | Gentisein | 22.333 | 244 | 5.6 f | 4.0 f | NA | NA | NA |
| 36 *** | 2-(4-羟基-3-甲氧基苯基)-1-(3,5-二羟基苯基)乙酮 | 24.465 | 274 | 2.4 f | 1.9 f | NA | NA | NA |
| 37 *** | 4-羟基苯基3,4,5-三甲氧基苯甲酸酯 | 26.633 | 304 | 4.8 f | 2.1 f | NA | NA | NA |
| 38 *** | 1,2-双(4-羟基-3-甲氧基苯基)乙酮 | 27.666 | 288 | 5.3 f | 2.6 f | NA | NA | NA |
| 39 *** | 1-(4-羟基-3,5-二甲氧基苯基)-2-(4-羟基-3-甲氧基苯基)ethanon | 29.714 | 318 | 4.5 f | 1.1 f | NA | NA | NA |
| 40 *** | 2-(4-羟基-3,5-二甲氧基苯基)-1-(4-羟基-3-甲氧基苯基)乙酮 | 29.725 | 318 | 2.2 f | 0.6 f | NA | NA | NA |
| 41 *** | 2- Syringylacetosyringone | 30.345 | 362 | 2.0 f | 0.2 f | NA | NA | NA |
| 42 *** | Vanillosyringil | 30.748 | 332 | 1.8 f | 0.2 f | NA | NA | NA |
| 43 *** | 1,2-双(4-羟基-3,5-二甲氧基苯基)乙酮 | 31.397 | 348 | 8.4 f | 0.6 f | NA | NA | NA |
| 44 *** | Syringil | 32.299 | 362 | 1.7 f | NA | NA | NA | NA |
| 45 *** | 1-(4-乙酰基-3,5-二甲氧基苯基)-2-(4-羟基-3,5-二甲氧基苯基)乙烷-1,2-二酮 | 34.138 | 388 | 2.3 f | 0.9 f | NA | NA | NA |
| 46 *** | 苯酚,4,4' - (1,2-乙二基)双[2,6-二甲氧基 - ,二乙酸酯 | 36.744 | 418 | 4.9 f | NA | NA | NA | NA |
*化合物经标准验证
**化合物与参考质谱比较
***由片段衍生的化合物
缩短了 RT的保留时间
b基于每种化合物的分解面积计算抑制剂残留量
c通过羟甲基糠醛的校准确定浓度
d通过2,5-己二酮的校准确定浓度
e通过香草醛的校准确定浓度
f通过校正丁香醛确定浓度
overliming和AC都显着去除了鉴定的化合物,尤其是芳香族单体和二聚体(图 1)。除了2,5-呋喃二甲醛,5-乙基呋喃-2-甲醛和2,5-己二酮之外,AC处理似乎除去了比重叠更高百分比的大多数化合物。顺序加灰过量和AC除去大部分的第一,第二和第三组化合物(图的 1 d)。在本研究中,只有顺序方法才能显着改善杨树预水解产物的ABE发酵。
特别是对于过量处理,在过量处理后(通过GC / MS,表1确定) ,糠醛含量从3360.9降低至736.8mg L -1,降低了78%。HMF含量从625.5降低至216.8 mg L -1,降低了65%(表 1)。类似地,对于AC处理,糠醛含量降低了79%并且HMF含量降低了74%(通过GC / MS测定)。以前,已经报道了甘蔗渣水解产物通过Ca(OH)2解毒的类似结果[ 26 ]。使用过量和5.0%AC的顺序处理可以进一步将糠醛和HMF含量降低至378.4和11.6 mg L -1,分别(由GC / MS确定)。虽然糠醛和HMF不是强抑制剂,但它们被认为是预水解产物相对毒性的重要指标[ 4 ]。
至于芳香族单体,过量除去香草醛,丁香醛和乙酰丁香酮分别为65%,67%和53%。然而,5.0%AC和顺序方法完全去除了所有三种化合物。这表明AC在除去芳香族单体方面比过度染色更有效。对于芳香族二聚体,过量使gentisein减少29%(从5.6到4.0 mg L -1),4-羟基苯基3,4,5-三甲氧基苯甲酸酯减少56%(从4.8到2.1 mg L -1),而5.0% AC完全去除了所有12种芳香族二聚体。这表明AC由于其较高的疏水性而在去除芳香族二聚体方面更有效。
如图2所总结, 来自未处理的预水解产物的潜在抑制剂由77.4%呋喃,21.3%芳族单体和少量脂族衍生物和芳族二聚体组成。降解化合物的抑制作用根据其化学结构而有很大差异[ 6 ]。据报道,低浓度(<3 g L -1)的糠醛和HMF可以提高C. beijerinckii BA101的ABE产量[ 37 ]。这种刺激作用可能是由于拜氏梭菌中氧化还原平衡的变化,因为NADPH或NADH用于将糠醛还原为糠醇[ 38]]。据报道,芳香醛(如苯甲醛,2-羟基苯甲醛和香草醛)限制了丙酮丁醇梭菌的生长和丁醇产率[ 39 ]。
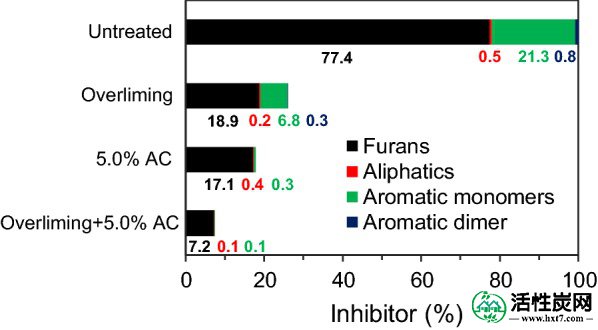
抑制剂组成改变了解毒的预水解产物。未处理的预水解产物中的抑制剂浓度假定为100%。基于表1中的质量浓度计算百分比
结果显示,过量除去75.6%的呋喃衍生物和68.1%的芳族单体(图 2)。碱催化的醛醇缩合反应已被认为是以前去除呋喃醛的主要反应[ 21 ]。2,5-己二酮可能发生相同的反应。相比之下,5.0%AC除去了77.9%的呋喃衍生物和98.6%的芳族单体。AC通过过量除去了更多芳香族单体和二聚体。它表明AC在从预水解产物中除去芳香族化合物方面更有效。之前已经报道了类似的结果[ 40],其中38.7%的糠醛和57.5%的总酚类化合物被AC还原,45.8%的呋喃和35.8%的酚类化合物通过过量消除而被消除。以前,有人建议AC可以选择性地除去羧酸以外的呋喃和酚类化合物,因为它具有很强的疏水性[ 41 ]。顺序过量和5.0%AC除去了90.7%的呋喃和99.5%的芳族单体(图 2)。以前,紫外 - 可见(UV-Vis)光谱已用于监测预水解产物中的呋喃[ 42 ]。在该研究中,在未处理和处理的预水解产物中观察到278nm处的主峰(附加文件1:图S48)。在过量给药和5.0%AC解毒后,278nm处的吸光度分别下降了12.6和77.0%。这表明在278nm处的吸光度不仅与呋喃有关,而且与酚类化合物有关。因此,过量和AC处理的整合可以更有效地去除呋喃和酚类化合物(芳族单体和二聚体)。其有效性将在以下ABE发酵过程中评估。
对于有机酸的去除,在没有提取样品的衍生化的情况下,本研究中通过GC / MS检测到的有机酸很少。以前,在三氟双(三甲基甲硅烷基)乙酰胺和氯三甲基硅烷衍生化后,在杨树水解产物中已经鉴定出超过30种脂肪酸和酚酸[ 43 ]。在本研究中,HPLC和LC-QTOF用于测定解毒后短链脂肪酸和酚酸的去除(表 2))。观察到,通过过量处理和AC处理,脂肪酸没有太大变化,甚至连续过量和AC处理仅去除了17%的甲酸和10%的乙酰丙酸。然而,过量和AC显示出酚酸去除的显着差异。AC除去过量后,去除了明显更多的酚酸。结果表明,AC处理后,肉桂酸,二羟基苯甲酸,香豆酸,香草酸和阿魏酸可分别以100,100,100,85.74和10%的比例去除(表 2))。然而,在过度处理后,它们分别仅减少了74.69%,13.99%,1.13%,32.61%和60.94%。因此,顺序解毒去除了96.8%的总酚酸。通过过量和AC去除二醛/二酮和酚酸的差异可用于解释它们在用于ABE发酵的预水解产物的解毒中的协同作用。
解毒对有机酸去除的影响
| 化合物名称 | 有机酸去除率(%) | ||
|---|---|---|---|
| 过量石灰 | 5.0%AC | 重叠+ 5.0%AC | |
| 脂肪酸 | |||
| 甲酸 | 8 | 14.0 | 17.0 |
| 醋酸 | 0.0 | 0.0 | 0.0 |
| 乙酰丙酸 | 5 | 6 | 10.0 |
| 酚酸 | |||
| 苯甲酸 | 32.2 | 49.5 | 68.2 |
| 肉桂酸 | 74.7 | 100.0 | 100.0 |
| 二羟基苯甲酸 | 14.0 | 100.0 | 100.0 |
| 香豆酸 | 1.1 | 100.0 | 100.0 |
| 香草酸 | 32.6 | 85.7 | 93.9 |
| Homovanillic acid | 62.1 | 89.5 | 100.0 |
| 阿魏酸 | 60.9 | 100.0 | 100.0 |
| 丁香醇酸 | 38.8 | 100.0 | 100.0 |
应该注意的是,过量给药和AC解毒都会导致糖分流失。结果显示,7.2%的糖在过量滴注中丢失,而在5.0%AC中则为4.8%的糖。连续过量和5.0%AC导致8.4%的糖损失(表 3)。
解毒对预水解产物中糖损失和总抑制剂浓度的影响
| 治疗 | 糖浓度(g L -1) | 总抑制剂浓度(g L -1) | ||||
|---|---|---|---|---|---|---|
| 葡萄糖 | 木糖 | 半乳糖 | 阿拉伯糖 | 甘露糖 | ||
| 未处理 | 67.85±1.67 | 8.93±0.13 | 1.04±0.10 | 0.64±0.08 | 1.94±0.10 | 5.68 |
| 过量石灰 | 62.98±0.31 | 8.00±0.23 | 0.98±0.11 | 0.56±0.11 | 2.12±0.12 | 1.47 |
| 5.0%AC | 64.85±0.38 | 8.26±0.03 | 0.93±0.05 | 0.61±0.05 | 1.89±0.13 | 1.00 |
| 重叠+ 5.0%AC | 62.51±0.28 | 7.84±0.33 | 0.93±0.19 | 0.51±0.05 | 1.89±0.08 | 0.41 |
用过量溶解,5.0%AC和连续过量染色和5.0%AC解毒的预水解产物进行用糖丁酸梭菌进行ABE发酵(表 4)。结果表明单独使用过量和5.0%AC都不能使预水解产物发酵。连续过量染色和5.0%AC导致显着的发酵能力和高丁醇产率(0.22g g -1糖)。这与最近关于Clostridium beijerinckii CC101的丁醇产量的报告很吻合 [ 44 ]。丙酮,丁醇和乙醇的最终浓度分别为7.1,13.2和1.0g L -1。ABE产率达到0.35g g -1糖,类似于纯葡萄糖发酵(0.36克g -1糖)。这表明过量染色和AC处理对预水解产物的解毒显示出协同效应。过量和AC解毒一些常见的抑制剂,如呋喃衍生物和酚醛和酮,但也选择性地去除一些特定的抑制剂。表 1显示,与AC相比,过量除去了更多的2,5-呋喃二甲醛,5-乙基呋喃-2-甲醛和2,5-己二酮。例如,2,5-呋喃二甲醛通过过量降低从148.8降至29.9 mg L -1,仅降至53.6 mg L -1由AC。2,5-呋喃二甲醛和2,5-己二酮是二醛和二酮。相反,AC似乎在去除酚酸方面更有效(表 2)。据报道,香豆酸,香草酸和阿魏酸可抑制拜氏梭菌(Clostridium beijerinckii)的丁醇发酵[ 45 ]。在顺序解毒,这两个二醛/二酮和酚酸被显著去除(表 1,,2)。2)。这可能是顺序解毒能够为预水解产物进行显着的ABE发酵的原因。应该注意的是,在顺序解毒中除去的脂肪酸(甲酸,乙酸和乙酰丙酸)不多(表 2)。
解毒方法对ABE发酵产物产量的影响
| 样品 | 发酵后的总糖a(g L -1) | C 酸(g L-1) | C 丁醇(g L-1) | Y 丁醇(g g-1糖) | C ABE(g L-1) | Y ABE(g g -1糖) |
|---|---|---|---|---|---|---|
| 葡萄糖控制 | 10.28±1.10 | 0.68±0.08 | 11.18±0.03 | 0.25±0.01 | 15.94±0.16 | 0.36±0.02 |
| 未处理 | 67.19±0.81 | 6.18±0.21 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| 过量石灰 | 62.01±1.75 | 6.05±0.19 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| 5.0%AC | 63.70±1.06 | 6.22±0.17 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| 重叠+ 5.0%AC | 5.89±0.25 | 3.93±0.29 | 13.36±0.35 | 0.22±0.02 | 21.26±0.47 | 0.35±0.09 |
C 酸代表乙酸和丁酸的最终浓度96小时; C 丁醇代表丁醇产量96小时; Y 丁醇代表基于总糖消耗的96小时丁醇产率; C ABE表示ABE产量为96小时; Y ABE代表基于总糖消耗的96小时的ABE产量
一个发酵的原始糖浓度稀释至prehydrolysates的90%由于接种梭菌。葡萄糖对照的初始浓度为54.86g L -1
以前的研究表明,通过过量使用呋喃和酚类物质显着减少[ 4 ],而甲酸,乙酸和乙酰丙酸保持不变。虽然可以通过C. saccharobutylicum消耗乙酸,但甲酸和乙酰丙酸可能对梭菌有毒。在脱毒的预水解产物中存在显着量的乙酸(~8.6g L -1),其中大部分被消耗并在96小时后转化为丙酮(7.0g L -1)。
AC解毒效率取决于多少AC在过程[使用23,46,47 ]。在顺序解毒过程中,过量给药后的预水解产物进一步用1.0,2.5,5.0和10.0%(w / v)的AC处理。结果表明,用顺序过量和1.0%AC处理的预水解产物没有产生ABE(图 3)。用顺序过量和2.5%AC处理的预水解产物产生约5.6g L -1的丁醇和8.9g L -1的ABE。最终的丙酮和乙醇浓度分别为2.8和0.4g L -1。相当数量的葡萄糖(28克L -1)发酵96小时后仍然存在。这表明在这种条件下,预水解产物部分解毒。丁醇产量达到13.2g L -1,预水解产物用连续过量处理和5.0%AC处理。ABE产量为21.3g L -1,其类似于用顺序过量处理和10.0%AC处理的预水解产物。应该注意的是,连续过量染色和10.0%AC解毒导致比连续过量给药和5.0%AC解毒更多的糖损失。已经报道了通过AC去除甲酸的剂量依赖性的相似观察[ 23 ],其中1.0%AC去除了47.3%的糠醛和5.0%AC去除了硬木预水解产物中75.5%的糠醛。
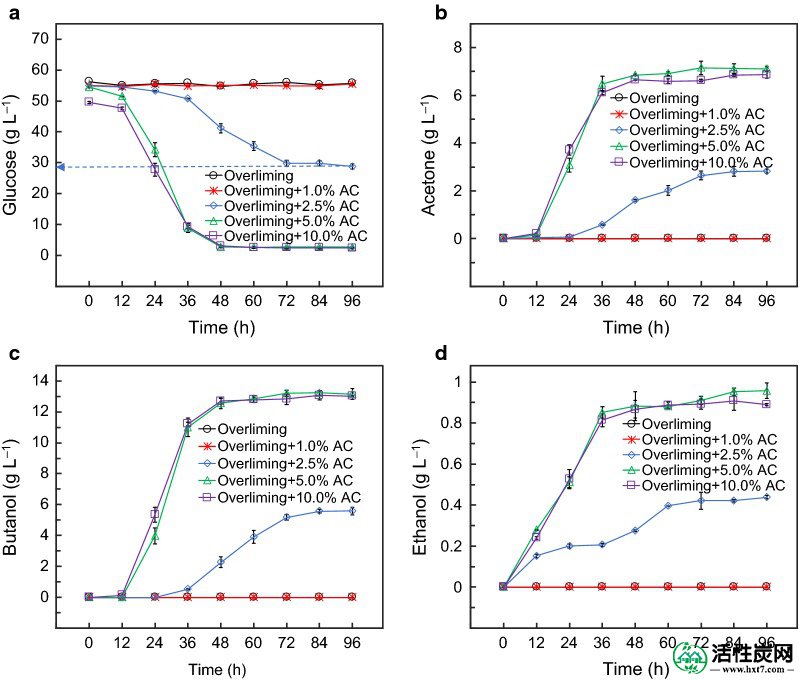
序贯解毒对丙型水解产物ABE发酵的影响。一个葡萄糖消耗,b丙酮生产,Ç乙醇生产,和d丁醇生产
为了检查和酵母之间的不同公差C. saccharobutylicum,所述灰过量处理prehydrolysates用酵母发酵以及(表 5)[ 48 - 50 ]。结果表明,过量解毒的预水解产物表现出与葡萄糖对照相当的发酵能力。具体地,在12小时内乙醇产量达到0.40g g -1糖。类似的结果已经报道了通过检查在乙醇发酵[羰基抑制剂的效果8,30,51,52 ]。Martiniz等人。用大肠杆菌获得0.45g g -1糖的乙醇产量过度戒毒后[ 26]。如上所述,过度处理的预水解产物不能与糖丁酸梭菌发酵。这表明C. saccharobutylicum对预水解产物抑制剂更敏感,并且用C. saccharobutylicum进行ABE发酵需要不同的解毒方法。
过量对初始糖浓度和酵母发酵的影响
| 样品 | 初始糖浓度(g L -1) | 总糖消耗量a(g L -1) | C 乙醇b(g L-1) | Y 乙醇c(g g -1糖) | ||||
|---|---|---|---|---|---|---|---|---|
| 葡萄糖 | 木糖 | 半乳糖 | 阿拉伯糖 | 甘露糖 | ||||
| 葡萄糖控制 | 20.11±0.36 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 20.11±0.36 | 8.32±0.20 | 0.41±0.07 |
| 未处理 | 19.94±0.24 | 8.94±0.17 | 1.02±0.04 | 0.68±0.01 | 2.02±0.10 | 1.89±0.13 | 0.00±0.00 | 0.00±0.00 |
| 过量石灰 | 18.76±0.19 | 8.25±0.59 | 0.87±0.02 | 0.67±0.00 | 2.24±0.20 | 24.59±0.16 | 9.82±0.40 | 0.40±0.01 |
一个总糖的消耗通过五种糖的还原的总和计算
b C 乙醇代表48小时的乙醇产量
c Y 乙醇表示基于总糖消耗的48小时的乙醇产率
在解毒处理后观察到用过的AC的表面积损失(图 4)。用于AC的Brunauer-Emmett-Teller(BET)表面积为427.1m 2 g -1,与原始AC(517.3m 2 g -1)的值相比降低了17.4%。另外,微孔的表面积(孔径<2nm)从244.6降至173.6m 2 g -1,这被认为是分子吸附的关键贡献。热再活化后,表面积可提高到98.7%(510.7 m 2 g -1)原AC。由于吸附物(抑制剂)在热处理过程中挥发或热分解成气体和碳,因此实现了良好的回收能力。
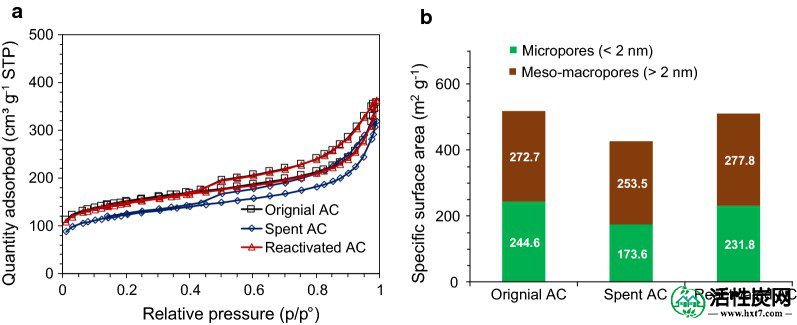
等温图(a)和原始,用过的和重新激活的AC的表面积(b)
为了检查AC是否可以在顺序解毒中再循环,将再活化的AC用于预水解产物的解毒用于ABE发酵。结果显示连续过量和重新激活的AC中的糖损失与连续过量和原始AC中的糖损失相似(8.4%对8.0%)。在48小时内消耗了大约94.2%的总糖,最终的丁醇浓度达到13.81g L -1。丁醇和ABE产率分别达到0.22和0.34g g -1糖(图 5a)。结果表明,可以AC生物质预水解产物的用于ABE发酵(图顺序解毒再循环 5 b)中。
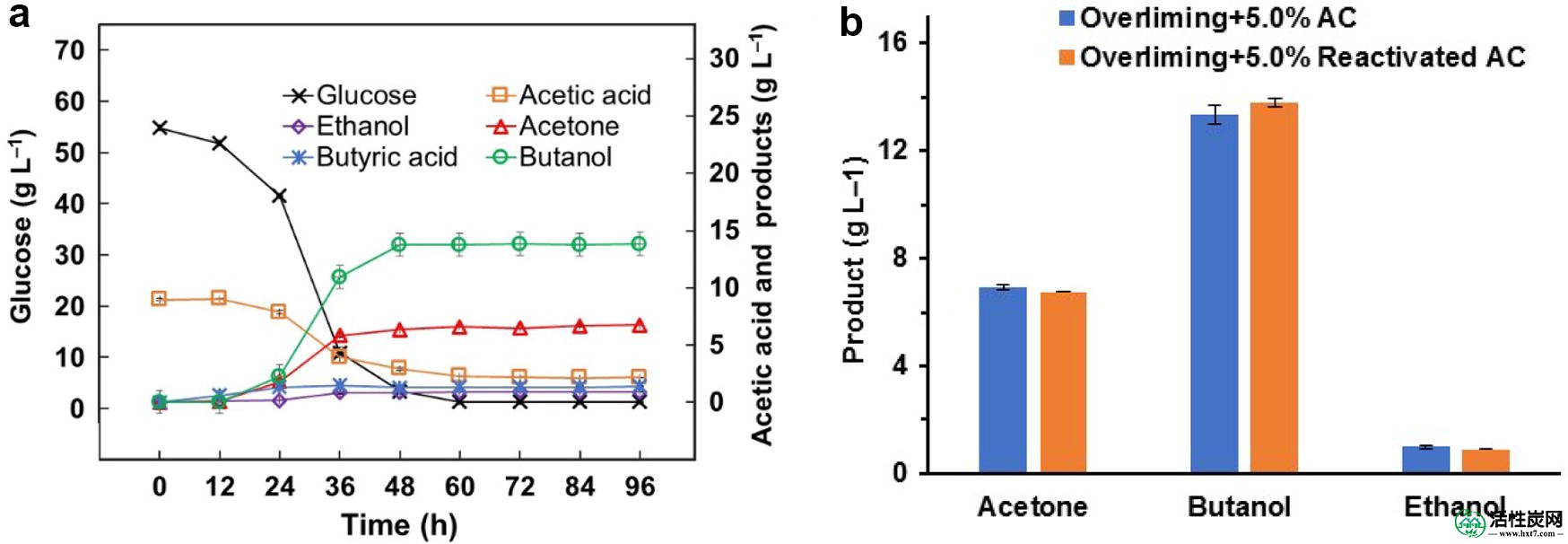
通过连续过量和重新激活的AC解毒的预水解产物的ABE发酵。一个葡萄糖消耗和ABE生产,b原始AC之间ABE生产比较和重新激活AC解毒
单独的过量和AC不能使预糖解产物与C. saccharobutylicum发酵。顺序过量和AC导致显着的发酵能力和0.22 g g -1糖的高丁醇产率,接近纯葡萄糖发酵(0.25 g g -1)糖)。观察到过量和AC解毒对ABE发酵的协同作用。观察到脂肪酸没有通过过量处理和AC处理而改变。然而,过量和AC显示出酚酸去除的显着差异。与AC处理相比,过量清除除去了更多2,5-呋喃二甲醛,5-乙基呋喃-2-甲醛和2,5-己二酮,而AC处理除去了过量的酚酸。通过过量和AC去除二醛/二酮和酚酸的差异可能是它们在用于ABE发酵的预水解产物的解毒中协同作用的主要原因。
观察到AC由于其疏水性而更有效地去除酚酸,并且由于碱催化的醛缩合反应,过量吸附在去除某些二醛和二酮方面更具选择性。AC解毒的效果取决于该过程中使用的AC量。与丙酮丁醇梭菌相比,酵母对过度处理的预水解产物显示出更大的耐受性。该研究表明,与乙醇发酵相比,生物质预水解产物的ABE发酵需要不同的解毒作用。