发布日期:2018-11-19 10:02 来源:活性炭网 作者:活性炭网 浏览数:
粉末状活性炭(AC)通常用作增强厌氧消化(AD)的有效添加剂,但对于添加AC产生的代谢途径如何改变微生物关联网络和增强食物垃圾处理知之甚少。 在这项工作中,探讨了在食品废物
近年来,世界各地日益增加的食物浪费(FW)增加了对减少和有效利用FW的需求1。FW的不受控制的处置可能会引起公共卫生问题并对环境造成不利影响。厌氧消化(AD)已经成为治疗FW和生物能源生产经过验证和有前途的方法2,3。在AD过程中,可生物降解的有机物质可通过厌氧微生物转化为生物气(CH 4和CO 2)。然而,在AD过程4期间,FW的AD在高有机负荷率(OLR)下仍然面临过程稳定性和有效性的挑战。
AD是一种复杂的生物过程,它含有许多不同功能的微生物群5。具体而言,水解和发酵细菌最初将复杂的有机化合物转化为挥发性脂肪酸(VFA),醇和乳酸。这些中间产物通过发酵细菌进一步转化为乙酸盐,H 2,CO 2和甲酸盐,其由产甲烷菌用于乙酸裂解和氢营养产甲烷。传统的H 2 -利用产甲烷菌可以通过使用发酵的终产物如H 2 / CO 2来产生甲烷,所述发酵的终产物来源于互补性细菌的同种异体代谢。兼营性细菌与H的关系2 -利用产甲烷菌是同生的,这个过程是有充分证据的种间氢转移(IHT)6。同种异体细菌的活性易受AD 7液相中的氢浓度的影响。在高OLR下,如果产甲烷对氢的去除率相对较低,则IHT过程的热力学将受到抑制,导致VFA积累,pH下降和AD操作失败。
通过在蒸煮器中加入导电性碳材料的增强AD抵抗高OLRs最近有报道8。进一步的研究表明,直接种间电子转移(DIET)被认为是IHT替代性间质代谢的替代方法9。该过程可以解释为通过生物电连接从细菌直接电子转移到电子接受的产甲烷菌的机制,例如导电菌毛10和外表面c型细胞色素11。然而,大多数这些研究仅用于探索使用简单底物9或纯培养物10的潜在机制由于AD过程12中复杂有机底物的降解过程的复杂性,因此限制了代谢机制的探索。对于FW,除了通过IHT或DIET通过间充质细菌进行AD中间产物的间充质代谢之外,通过其他细菌的水解和发酵过程也在AD过程13中起重要作用。例如,脂质的水解和产酸被认为是用于FW的AD的一个关键限制步骤,由于其生物难和疏水性14,15。因此,除非水解和产酸作用良好,否则不太可能有效地进行同种异体代谢。然而,整个社区层面的潜在微生物网络和代谢途径尚未得到研究,特别是对于FW的AD。
基于上述考虑,在AD系统中添加AC用于FW处理和甲烷生产。通过使用高通量测序技术的宏基因组鸟枪测序技术,深入了解AC对微生物网络(包括水解和发酵细菌,营养细菌和产甲烷菌)的互动关系的影响,通常产生数百万至数十亿读取从AD反应器的污泥样品中提取的宏基因组DNA。此外,通过代谢途径分析方法探讨了AC对所有微生物的营养不良机制和代谢途径的影响,该方法基于京都基因和基因组百科全书数据库提供了基因功能,蛋白质功能和酶促反应的系统信息。 。
在平行操作的五个AD反应器中研究了AC添加对甲烷产生的影响:四个AC增强的AD反应器,添加不同含量的AC:4g,12g,20g和28g,并且对照AD反应器没有加入AC。累积甲烷产量(CMY)(图 1A),特定甲烷产量(SMP)(图 1B),COD(图 1C)和pH(图 1D)在增加的OLR从1.5至6g VS. L -1 ·d -1。
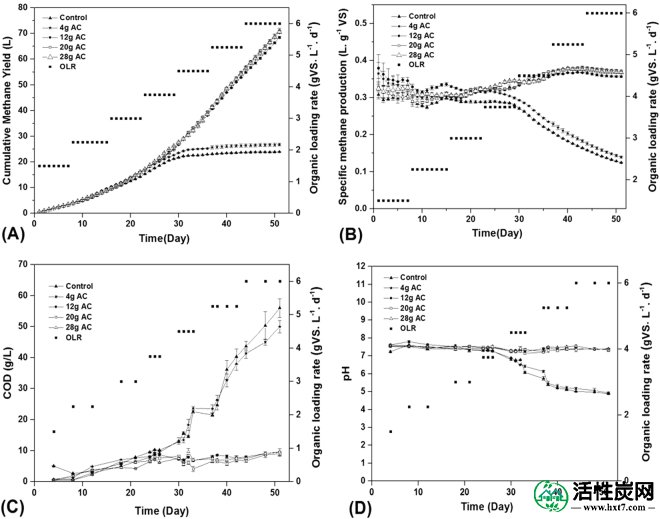
不同剂量的AC对(A)累积甲烷产率,(B)特定甲烷产量,(C)COD浓度和(D)pH的影响。
在OLR的最初22天达到3 g VS·L -1 ·d -1时,5个AD反应器中的平均CMY和SMP分别增加到15.6 L和0.32 Lg -1 VS,并且所有反应器均稳定运行平均出水pH值为7.4。由于OLR较低,五个AD反应堆之间的差异并不显着。当OLR增加到6 g VS·L -1 ·d -1时,添加AC大于或等于12 g的AD反应器中的CMY保持在68.5 L和71.2 L之间,SMP保持在0.36 Lg之间-1 VS和0.37 Lg -1VS平均出水pH值为7.3。AD反应器中CMY仅为24.2 L和22.3 L,分别添加4 g AC和对照反应器,SMP分别降至0.14 Lg -1 VS和0.12 Lg -1 VS,这可能是由COD浓度高达50至56 g·L -1这些结果表明,12 g AC是耐受高FW加载速率和促进甲烷产生的最佳添加剂量,因为AC剂量的增加不能显着改善AMY和SMP,而AC剂量低于12g对甲烷生产的AD性能的提高没有积极作用。这种现象可以通过在AD反应器中构成大多数产甲烷菌的古细菌的丰度来解释。从图 S1可以看出,12 g AC反应器污泥样品中古菌的16S rRNA基因拷贝数为2.93×10 6拷贝/μL - DNA,显着高于5.29×10 5复制/μL - AD反应器中的DNA含4 g AC。然而,20个AC和24个AC的AD反应器中古菌的16S rRNA基因拷贝数分别仅为3.16×10 6拷贝/μL - DNA和3.09×10 6拷贝/μL - DNA,没有显着差异。 AD反应器采用12 g AC。
AC是一种无定形碳质材料,具有较高的孔隙率,较大的表面积和较强的吸附能力。因此,四个AD反应器中的AC表面可以为厌氧菌定殖提供良好的环境,特别是对于产甲烷菌,这可能有助于反应器稳定运行。太低的AC量可能会降低AC 16的活性位点的量并影响AD反应器16中产甲烷菌的富集,这可能是解释AD反应器添加4g AC时性能差的可能原因。然而,过量的AC也不能进一步增强产甲烷菌的富集和提高反应器性能。
运行51天后,通过宏基因组鸟枪测序分析了种子污泥污泥样品,无AC(A1)的对照反应器和添加12g AC(A2)的AD反应器中的整个微生物群落。多物种分类学分析表明,细菌和古菌种群是主要的微生物群落,占总微生物种群的97%以上(图 2A,B)。剩下的种群是Metazoa,Unclassified Viruses,Fungi,Viridiplantae和Plasmodium_chabaudi,只显示了整个微生物群落的一小部分。分层聚类分析(图 S2)表明种子污泥和A2中的微生物群落被分类为一个群集。该簇与A1分离,表明A1中的微生物群落结构在没有添加AC的情况下显着改变。

A1(A)和A2(B)污泥样品运行51天后,整个AD微生物群落的多级物种分类示意图。通过分析合并的基于配对末端的16s rRNA基因,在结构域和门水平上鉴定了从内部到外部环的微生物群落组成。根据GraPhlAn分析,反应器A1(C)和A2(D)中显性AD微生物群落的系统发育和分类树。选择前100个属来构建系统发育树,并将前20个属的相应门(标有星号)标记为不同颜色。圆圈和星号的大小代表微生物种群的不同相对丰度。
图S3中差异比较的误差条形图 进一步表明A2和A1与种子污泥之间微生物群落的差异主要归因于变形菌,拟杆菌和Euryarchaeota的比例(p <0.05)之间的差异。Proteobacteria和Bacteroidetes包括发酵,产乙酸和同种异体细菌,可以发酵有机化合物和降解VFA 17。如图2C中的循环系统发育树的外环 所示,D,Proteobacteria下的两个显性属(Smithella,Desulfobulbus)由于添加了AC,在细菌群落中的拟杆菌下的两个显性属(黄杆菌和Lentimicrobium)在A2中被选择性富集。A2中Proteobacteria的相对丰度为总微生物群落的16%,而A1中仅为5%。发现具有将硫酸盐还原为硫化氢的能力的Desulfobulbus也通过发酵复合有机化合物18参与丙酸盐和乙酸盐的生产。Smithella是典型的互补性VFA氧化细菌,已知会将丁酸盐和/或丙酸盐降解为乙酸盐并产生H 2。该属通常通过IHT 与H 2 -利用产甲烷菌具有亲缘关系。拟杆菌属中的大多数属于水解和发酵细菌19,例如黄杆菌属和Lentimicrobiu属,以及其他属,例如拟杆菌属和Alistipes。这些属参与VFA,CO 2和H 2的产生,通过碳水化合物,脂质和蛋白质发酵多糖和蛋白聚糖切割产生的酶19,20。
Euryarchaeota包含AD反应器中的大多数产甲烷菌。从图 2A,B中,除了Thermoplasmata,Thermococcales和Halobacteria之外,Euryarchaeota门中超过93%的厌氧菌属于产甲烷菌。Euryarchaeota的相对丰富在A2中,微生物群落占总微生物群落的15%,显着高于种子污泥中的4%和A1中的3%。这些结果表明,在A2中添加AC有助于富集产甲烷菌,在AD过程中提高甲烷产率起着至关重要的作用。在代谢途径的基础上,产甲烷菌可分为乙酸产甲烷菌和利用氢的产甲烷菌。如图2C中的循环系统发育树的外环 所示,D,四种显性产甲烷古菌(A,B,C,D),三种氢营养型产甲烷菌(Methanoregula,Methanolinea,Methanoculleus)和一种乙酸产甲烷菌(Methanosaeta)。仅富含A2。即使通过A1也有3%的Euryarchaeota,每个属的相对丰度低于总微生物群落的1%。在A2的污泥样品中,Methanosaeta占总微生物群落的5%。众所周知,Methanosaeta能够通过参与DIET 10直接接受来自CO 2还原的电子以产生CH 4。然而,DIET仅被报道的定义共培养物发生Geobacter metallireducens则和地杆菌硫还原或地杆菌物种和乙酸分解甲烷10,21。Geobacter包括在内变形菌。如图S4所示, A2 中Geobacter属的相对丰度为细菌群落的0.8%,远高于A1中的0.08%和种子污泥中的0.3%。Geobacter metallireducens则和地杆菌硫还原是两个主要的地杆菌在A2种占总数的25%,地杆菌的物种。随着Methanosaeta属和Geobacter属的增加,Geobacter和Methanosaeta之间的潜在饮食可以建立以改善AD中间产物(例如丙酸盐,丁酸盐和乙醇)的同种异体代谢。因此,通过添加AC,可以增强DIET对A2中FW的AD的贡献。此外,占优势的氢营养型产甲烷菌,Methanoregula,Methanolinea和Methanoculleus,占古菌群落的41%。氢营养型产甲烷菌的富集在通过将CO 2 / H 2还原为CH 4来保持低H 2压力中起主要作用,并且已经发现通过营养不良的氧化细菌22对VFA向乙酸盐的共同代谢具有重要作用。
AD过程通常需要多组微生物共同作用以将有机底物转化为甲烷。因此,为了研究与整个微生物群落变化相关的彻底的微生物网络,了解不同微生物之间的关系是非常重要的。特别是,分析AC对微生物群落的影响至关重要。如图3A所示 ,构建了微生物共生网络,以显示A1,A2和种子污泥中所有微生物之间的相关性。所有饼图的面积相似,只是“其他”的馅饼由几种非显性微生物组成,这表明每个微生物属的相对丰度的差异几乎不显着。该结果可能部分归因于底物和降解过程的复杂性,其通常需要多个属的联合作用,与可能仅需要有限量的属的简单底物如乙酸盐相比。馅饼“其他”的较大区域表明,即使优势微生物通常在AD过程中起主要作用,一些非优势微生物的功能也是必不可少的。红线和绿线分别尊重不同属之间的正负相关。正相关通常包含交叉进食,共聚集,共定殖和生态位重叠23,有利于各种属中AD中间体的间充质代谢。在AD条件下,负相关通常源于对底物的竞争和差异生态位适应。大多数属的分布是密集的,除了位于外部边界的属,表明某些属与AD过程几乎没有关系,如病毒分类,Azospira和Mesotoga等,而一些属与AD过程不可分离,如拟杆菌和甲烷菌。
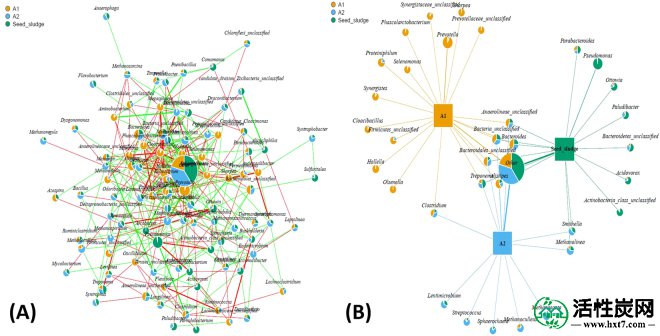
(A)微生物共同网络揭示了反应器A1,A2和种子污泥的所有污泥样品中不同属之间的强烈相互作用。饼图表示每个属的相对丰度。红线表示正关联,而绿线表示负关联。(B)微生物网络,表明种子污泥,反应器A1和A2中共有的和独特的优势属。
为了进一步研究AC对不同属间相互作用的影响,构建了A1,A2和种子污泥中的一个完整的微生物网络,其中优势微生物种群在每个属间具有显着差异(P <0.05)(图 3B)。该微生物网络揭示了在复杂系统中观察到的拓扑特征,形成了共享的相关性和特定的相关性。主要的共同相关性归因于A1和A2反应器中存在的相同微生物,以及种子污泥中的细菌,例如拟杆菌,密螺旋体,厌氧菌和其他。这些属涉及将复杂的有机化合物发酵成简单的底物,例如VFA,CO 2和H 2。共有领域中这些属的聚集的一种可能的解释是水解和发酵是AD过程中的第一步,其通过水解和发酵细菌的作用可以在可变环境中存活。然而,在A2中添加AC改变了AD环境并通过形成一些特定的相关性来重塑微生物网络,这些相关性归因于仅在A2中存活的特定属,例如Lentimicrobium,Streptococcus,Sphaerochaeta,Methanoculleus和methanosaeta。Methanoculleus和Methanosaeta分别归类为氢营养型产甲烷菌和乙酸产甲烷菌。Lentimicrobium,Streptococcus和Sphaerochaeta是严格发酵的细菌,通过发酵复杂的有机物产生VFA,乙醇,H 2 / CO 2。
为了理解和利用AC对微生物代谢的影响,进行了微生物群落代谢途径的分析。A1和A2中微生物群落的预测功能分析如图S5所示 。所有代谢功能分为代谢,环境信息处理,遗传信息处理,细胞处理,人类疾病和有机体系统,其中代谢是最主要的类别,包括几种代谢途径,例如碳水化合物代谢,氨基酸_代谢,脂质代谢,能量代谢和其他。代谢中的这些代谢途径表示在FW和生物能量产生中负责碳水化合物,蛋白质和脂质的分解和矿化的各种生物化学过程。然而,A1和A2之间代谢途径的差异除了能量代谢和脂质代谢之外几乎没有显着差异。由于在A2中添加AC,它们在全基因组的相对丰度中分别提高了2%和1%。https://www.ncbi.nlm.nih.gov/COG/)。如图S11所示, A2中能量产生和转化以及脂质转运和代谢的基因数分别为15030和5395,而A1中仅为13863和4825。能量代谢的增强主要归因于甲烷代谢途径(Ko00680)(图 4),其中产甲烷菌通过在AD过程中将简单底物转化为甲烷而获得生长能量(图 S6A)。这可能是A2中甲烷产率较高的可能生物学原因。
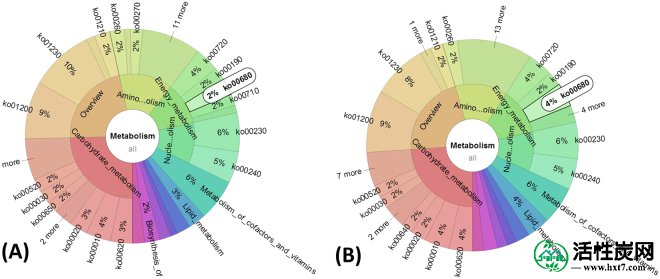
根据基因KEGG途径分析,微生物群落的代谢途径。(A,B)分别在A1和A2中的“代谢”类别中的整个微生物群落的功能概况分析。白色饼图表示基因ko00680在“代谢”类别中的相对丰度。
脂质代谢是指脂质的降解。脂质代谢的改善归因于脂肪酸降解途径,其中水解和发酵细菌通过几种功能酶的作用将长链脂肪酸和甘油脂转化为小分子脂肪酸(图 S6B)。脂质的降解仍然被认为是,因为包含在脂质生物难熔化合物的是主要包括脂肪和食用油的FW的AD的限制步骤14。此外,脂质的疏水特征易于影响脂质和微生物的混合,影响AD过程中脂质的降解。考虑到吸收能力,AC可以潜在地用作增强脂质代谢的有效添加剂,同时吸收脂质或油组分并促进微生物定殖,并随后通过微生物加速脂质的降解。为了证实这一点,使用食用油作为单一底物进行实验室规模实验以研究AC对脂质AD的影响。图 S7图中显示了在没有添加AC(CR)的情况下添加AC(ACR)和对照反应器的AD反应器中甲烷产率的变化。这两个AD反应器并联运行,增加OLR为1至6 g oil·d -1。在1g油·d -1的OLR下,两个反应器的平均甲烷产率在58和62ml·d -1之间变化,pH范围为7.0-7.2。这些差异并不重要。随着OLR的进一步增加,ACR的平均甲烷产量在OLR为6 g oil·d -1时单调增加至325 ml·d -1,平均pH值为7.3。CR的甲烷产率仅为175 ml·d -1并且平均pH保持在7.0。这些结果表明,在AD过程中添加AC可以增强脂质代谢,因此在改善FW处理和甲烷产生的AD性能中起主要作用。
图 S8显示了A1,A2和种子污泥中微生物群落的代谢途径的共同网络。根据馅饼的面积,具有Ko01200和Ko01230数量的代谢途径是所有反应器中最主要的代谢途径。Ko01200是碳代谢,包含糖酵解的碳利用途径,甲烷代谢的一些途径,以及其他碳固定途径。Ko1230是氨基酸的生物合成途径,用于将碳基化合物转化为氨基酸。这两种代谢途径是AD过程中用于降解有机化合物和甲烷产生的最基本方面。第二个主要的微生物代谢与Ko00230,Ko02024,Ko02010,Ko00720和Ko00620的代谢途径相关,对应于嘌呤代谢,群体感应,ABC转运蛋白,碳固定途径和丙酮酸代谢分别。这些结果表明,即使操作条件变化很大,大多数功能性代谢也发生在A1,A2和种子污泥的污泥样品中。然而,Ko00640的特定代谢途径仅存在于A2中(图2)。 5)。这种代谢途径是丙酸代谢,其中丙酸盐可以被增生细菌降解产生乙酸盐和甲醇作为终产物(图 S9)。该结果与A2中丙酸盐百分比(32%)较低的结果一致,与A1中的43%相比(图 S10)。由于高的吉布斯自由能为+ 76.1kJ /反应,丙酸盐与乙酸盐的互收性产乙酸反应在热力学上是不利的,因此丙酸盐在AD系统中易于积累,导致AD操作的不稳定性。这可能解释了A1的糟糕表现。与富含 Geobacter物种和Methanosaeta的潜在DIET结果一起(图 2和S4)和A2(图丙酸酯低 S10),在AD过程中加入AC的可能有助于加速丙酸的互养代谢和进一步提高广告效果。
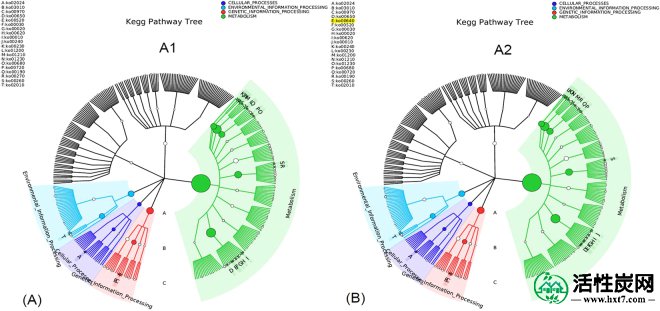
KEGG途径树代表反应器A1和A2中AD过程中的主要代谢途径。外环中的星号表示反应器A1,A2的主要代谢途径。(A)反应堆A1; (B)反应器A2。
构建了潜在的微生物协同网络,并通过引入AC确定了厌氧消化器中微生物群落的主要代谢途径。提出的微生物网络和主要代谢途径的概念图总结在图 6中。数据显示,AC加速了古菌的定植,提高了FW处理和甲烷产生的显着厌氧性能。与更高丰度的古细菌和甲烷产量一致,代谢途径分析的证据发现甲烷代谢途径同时增强。有趣的是,AC还增强了食用油的降解并改善了脂质代谢的途径,从而证明厌氧消化在食物垃圾处理方面具有更好的性能。在最近的研究结果相一致8,9,12,地杆菌物种和Methanosaeta加入AC均显著丰富,从而表明之间的电位DIET可以建立Geobacter和Methanosaeta以改善AD中间产物(例如丙酸盐)的同种异体代谢。重要的是,代谢途径分析的进一步证据支持了这种推测,因为AC产生了丙酸代谢的特定代谢途径,加速了丙酸的同种异体代谢。这些研究结果表明,通过研究微生物群落的16S rRNA,微生物关联网络和生物代谢途径的变化解释了AC如何增强食物垃圾的AD。
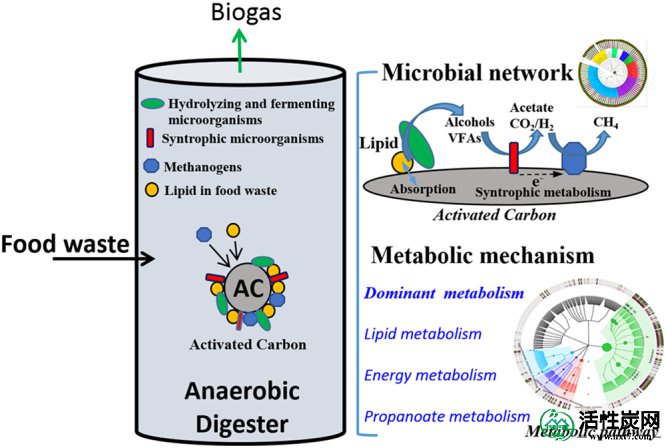
微生物网络的概念图和厌氧消化器中微生物群落的主要代谢途径通过结合AC。
在这项工作中,探讨了在食品废物厌氧消化系统中使用AC。使用生物信息学分析,分类树和KEGG Orthologs数据库,跟踪微生物网络和生物代谢途径的变化。
种子污泥是从新加坡Ulu Pandan Water Reclamation Plant的大型厌氧消化池中收集的。挥发性悬浮污泥(VS)与总悬浮污泥(TS)的比率为0.65,初始TS为13.2g / L. FW来自新加坡国立大学的食堂,主要包括米饭,面条,肉类,蔬菜和调味品。除去任何骨头和不可生物降解的废物如塑料袋后,用搅拌器将FW均化,然后储存在-20℃的冰箱中。FW的详细特征列于表 S1中。
进行了两次实验室规模的实验。首先,操作四个玻璃实验厌氧消化器用于FW处理,添加不同含量的粉末AC(200目):4g,12g,20g和28g。每个蒸煮器的工作体积为0.8L。对照蒸煮器与实验蒸煮器相同,但不添加粉末AC。粉末AC的孔体积和表面积分别为0.30cc / g和385m 2 / g。在播种种子污泥后,这五个厌氧消化器以半连续模式(每天喂养)操作FW的AD,随着有机负荷率(OLR)的逐渐增加。所有反应器在35℃下平行操作。污泥停留时间为30天。所有实验一式三份进行。
在获得FW AD的最佳AC剂量后,加入12g AC(以下称为ACR),操作两个玻璃实验厌氧消化器处理食物垃圾的食用油。对照消化器与实验消化器相同,但没有添加粉末AC(以下称为CR)。食用油用作唯一的底物。每个蒸煮器的工作体积为0.8L。所有反应器在35℃下平行操作。污泥停留时间为30天。所有实验一式三份进行。
根据制造商的说明使用HACH色度计(DR900,USA)测定COD。使用pH分析仪(Agilent 3200M,USA)记录pH。在103-105℃下干燥并在550℃下燃烧成灰分后,基于称重法测定TS和VS. CH 4使用配备有热导检测器的气相色谱仪(Clarus 580 Arnel,PerkinElmer,USA)测定产量。使用vario MICRO cube(Elementar,HANAU,Germany)测定FW中的C,N,S和H元素分析。使用电感耦合等离子体(ICP) - 光学发射光谱仪(Perkin Elmer Optima 5300V,USA)进行金属元素分析。使用Quantachrome Autosorb-6B通过N 2吸附测量来测量活性炭的BET表面积和孔体积。根据Zhang 等人描述的方法,使用实时PCR来定量总古细菌。24。
通过IIIumina HiSeq TM测序仪(IIIumina Inc.,USA)进行宏基因组DNA的测序。分析方法参考参考文献25,其包括DNA提取,DNA文库构建和测序,有效读数的筛选,DNA样品的高质量读取的组装,基因分类学分配,基因功能分类和其他相关分析。
简而言之,根据制造商的说明,使用提取试剂盒(MOBIO Laboratories,Inc.Carlsbad,USA)提取样品的宏基因组DNA。通过测定其在260nm和280nm处的吸光度来检查提取的DNA的纯度,并且我们使用Qubit 2.0(life,USA)测量DNA的浓度。为了获得有效和清洁的测序数据,原始测序结果由Trimmomatic 26处理如下:(1)有序的衔接子读取序列; (2)删除含有歧义的序列(“Ns”); (3)删除读数小于35nt。(4)去除低质量序列,即测序质量值低于20; (5)通过滑动窗口方案去除尾部质量小于20个碱基的序列。IDBA_UD软件根据读数和重叠之间的关系组装有效读数,以获得进一步翻译成蛋白质序列27的重叠群。总重复读数和重叠群的基本测序统计数据如表1所示 。随后,MetaPhlAn2软件通过具有有效读数的爆破标记基因指定分类学28。代谢途径和基因功能分类的分析通过DIAMOND进行29和HUMAnN 30通过与京都基因与基因组百科(KEGG)的数据库进行比较的蛋白质序列31 - 35。使用Krona 36和GraPhlAn 37构建多种物种/功能的配置图。根据基于非加权对组方法和算术平均值的层次聚类分析,构建聚类树。根据分类学的结果,通过STAMP进行物种方差分析,筛选条件P值低于0.05 38。通过QIIME 38和SPARCC分别对优势种(相对丰度≥1%)分析微生物网络和共网络。
用于分析的读数和重叠群的基本测序统计数据。
| 样品 | 总读数 | 重叠群数量 | N50 | Max Len | 总Len | 平均Len | GC内容 |
|---|---|---|---|---|---|---|---|
| A1 | 76406684 | 500699 | 1327 | 410518 | 455780585 | 910.29 | 50.64% |
| A2 | 52543088 | 421867 | 1781 | 286352 | 465262942 | 1102.87 | 51.16% |
| 种子污泥 | 62331322 | 582851 | 1237 | 153117 | 547000062 | 938.49 | 55.27% |